10. Кинетика химических реакций в растворах
Химическая кинетика изучает скорость и механизм протекания химических процессов, а также зависимость их от различных факторов. Помимо химических процессов в химической кинетике рассматриваются также скорости процессов фазовых превращений и процессов растворения. Прикладное значение кинетики определяется тем, что для практического использования какой-либо реакции необходимо уметь управлять ею, т.е. знать скорость ее протекания в данных условиях и способы изменения этой скорости. Теоретическое значение кинетики состоит в том, что изучение протекания процессов во времени позволяет выяснить многие важные особенности процесса, проникнуть в сущность механизма химического взаимодействия.
Конечный результат каждого химического процесса определяется термодинамическими закономерностями. Однако, рассматривая только исходное и конечное состояние системы, термодинамика не дает указаний ни о скорости достижения этого конечного (равновесного) состояния, ни о пути перехода к нему.
Эти вопросы решаются кинетикой. Дополнительные осложнения возникают в результате появления нового параметра — времени, входящего в понятие скорости, а также из-за увеличения числа изменяющихся факторов. Некоторые из них трудно учесть (посторонние примеси, стенки сосуда и др.), а все они определяют скорость и механизм перехода к равновесному состоянию.
Кинетические исследования позволяют определить порядок и константу скорости процесса, число и характер промежуточных продуктов, энергию активации реакции, выяснить влияние природы растворителя, установить характер и число связей, разрываемых в ходе реакции, и т.п.
Скорость реакции. Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. Так как скорость реакции изменяется с течением времени, то различают среднюю и истинную скорость реакции. Средней скоростью реакции за данный промежуток времени называется отношение уменьшения концентрации исходного вещества или увеличения концентрации продукта реакции ко времени, в течение которого это уменьшение или увеличение произошло:
V = ± (C2 – C1) / (t2 – t1)
Истинная скорость реакции V в данный момент может быть выражена изменением концентрации, отнесенным к бесконечно малому промежутку времени, т.е. производной от концентрации по времени:
V = ± dC / dt
Скорость реакции всегда считается положительной. При этом отношение и производная dC / dt могут быть положительными или отрицательными в зависимости от того, изучают ли скорость реакции по изменению концентрации одного из исходных веществ или одного из продуктов реакции. Концентрации исходных веществ по ходу реакции убывают. Например, для реакции
aA + bB = cC + dD
Концентрация вещества В (CB) убывает во времени (рис.29). При этом C2B < C1B и скорость реакции по веществу В dCB / dt < 0. Чтобы значение скорости было положительным, производную от времени следует брать со знаком «—». Концентрация продуктов реакции во времени возрастает, например, C2D > C1D и, поэтому производная от концентрации во времени имеет положительное значение dCD / dt > 0. Скорость реакции может быть выражена как производная от концентрации по времени для любого вещества, участвующего в реакции. Например, для реакции
2NO + O2 = 2NO2
каждая производная является скоростью реакции соответственно по компонентам NO, NO2, O2.
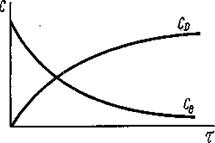
Рис. 29. Изменение концентрации одного из исходных веществ и одного из продуктов реакции во времени
Скорость реакции зависит от природы реагирующих веществ, их концентрации, наличия посторонних веществ (например, катализаторов или ингибиторов) и их концентрации; среды, в которой протекает реакция, и условий протекания реакции: температуры, давления (особенно для реакций с участием газов), облучения (фотохимические реакции) и т.п. Каждая химическая система с течением времени приходит в состоянии динамического равновесия, при котором скорость прямой реакции равна скорости обратной реакции. Согласно закону действующих масс, скорость реакции пропорционально концентрациям исходных веществ в данный момент времени. Например, для приведенной выше реакции: aA + bB = cC + dD
V1 = k1CAa*CBb
V2 = k2CCc*CDd
где V1 — скорость прямой реакции; V2 — скорость обратной реакции, k1 – константа скорости прямой реакции, k2 – константа скорости обратной реакции. Физический смысл константы скорости реакции состоит в том, что она численно равна скорости реакции при концентрациях всех реагирующих веществ равных единице. Константа скорости реакции зависит от тех же факторов, которые влияют на скорость реакции, кроме концентраций реагирующих веществ. Размерность константы скорости определяется тем кинетическим уравнением, по которому производится ее расчет.
При равновесии скорость прямой и обратной реакции равны: V1 = V2, следовательно
k1CAa*CBb = k2CCc*CDd
или
k1/ k2 = CCc*CDd / CAa*CBb
Отношение двух констант также является постоянной величиной и называется контантой равновесия химической реакции:
К = k1/ k2








