Задание 2. Определение температуры замерзания раствора и молекулярной массы растворенного вещества
Для определения молекулярной массы (М) растворенного вещества, помимо понижения температуры замерзания раствора, необходимо знать количество граммов растворенного вещества (g) и массу растворителя (W) в граммах. Моляльность раствора будет равна:
Сm = 1000*n / W
где n – количество молей растворенного вещества, равное g/M. Следовательно:
ΔТзам = K*Сm = К*1000*n / W
или
ΔТзам = (К*1000*g ) / (W*M)
откуда
M = (К*1000*g ) / (W* ΔТзам)
Для определения массы растворителя W необходимо объем растворителя, взятый для опыта, умножить на его плотность:
W = V*ρ
где V – объем растворителя (мл), ρ – плотность раствориталя (г/см3 или г/мл).
Если вещество, молярную массу которого необходимо определить, находится в твердом состоянии, то небольшое его количество отвешивают в специальной пробирке, переносят через отросток трубки А. Массу добавленного сухого вещества находят по разности массы пробирки с веществом и массы пробирки после переноса вещества.
В момент прибавления сухого вещества термометр из трубки А не вынимается, но поднимается так, чтобы шарик его находился несколько выше отверстия, через которое прибавляется вещество, сама же трубка удерживается в вертикальном положении. Таким путем устраняется возможность попадания отдельных крупинок вещества на стенки трубки и термометра. После прибавления термометр вновь вставляется на свое место, жидкость тщательно перемешивается до полного исчезновения крупинок прибавленного вещества, затем трубка А ставится в сосуд-охладитель и производятся измерения температуры замерзания раствора, аналогично тем измерениям, которые были описаны для растворителя.
На рис. 28 приведены характерные кривые изменения температуры растворителя и раствора в процессе их охлаждения. Минимальные точки этих кривых соответствуют температурам переохлаждения, подъем и остановки после них соответствуют температурам замерзания. Ход кривых после подъема у растворителя и раствора различен. Температура замерзания растворителя остается одной и той же вплоть до полного превращения его в твердое состояние, после чего температура начинает понижаться. Для раствора кривая после подъема сразу же начинает понижаться, что обусловлено увеличением концентрации раствора после того, как часть растворителя в растворе вымерзает. При измерении температуры замерзания раствора, рекомендуется не допускать понижения температуры переохлаждения жидкости больше, чем на 0,5° по сравнению с температурой замерзания чистого растворителя.
Определяют температуру замерзания раствора с точностью 0,003° не меньше двух раз, вычисляют понижение температуры замерзания раствора и вычисляют по формуле молекулярную массу.
Молекулярную массу вещества можно определить и тогда, когда оно уже находится в растворе. В этом случае необходимо знать массовую долю (процентную концентрацию) вещества в растворе и рассчитать количество граммов вещества в 1 мл раствора, а затем прибавлять это вещество к растворителю в строго измеренном количестве. При этом растворитель должен быть тем же самым и его количество, внесенное с раствором, должно быть прибавлено к массе растворителя, находящегося в пробирке А.
Раствор прибавляется или из пипетки, или из бюретки. В момент приливания термометр Бекмана также не вынимается из пробирки, а только слегка поднимается; в зазор между стенками пробирки и термометра вставляется конец пипетки (или бюретки) и, не погружая конца пипетки (бюретки) в растворитель, приливают отмеренный объем. Вынимают пипетку (бюретку), закрывают пробирку пробкой с термометром, тщательно перемешивают раствор мешалкой, вставляют в охладитель и производят измерения температур замерзания раствора, как было описано ранее.
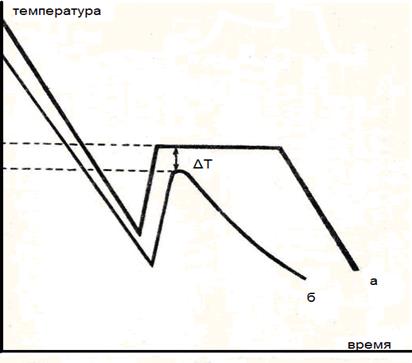
Рис. 28. Кривые охлаждения: а - растворителя, б - раствора, ΔТ- понижение температуры замерзания раствора








