Задание 5. Адсорбция красителей
Приготовить 6 чистых и сухих пробирок, пронумеровать их. В пробирки №1-3 вносят по 0,25 г измельченного активированного угля, который является гидрофобным адсорбентом. В пробирку №1 с углем по заданию преподавателя наливают 5 мл разбавленного и слабо окрашенного водного раствора кислотного красителя (пикриновой кислоты, эозина, или флуоресцеина). В пробирку №2 с углем по заданию преподавателя наливают 5 мл разбавленного водного раствора основного красителя (фуксина, бриллиант-зеленого, метиленового голубого, метилового фиолетового и др.). В пробирку №3 с углем по заданию преподавателя наливают 5 мл спиртового раствора какого-либо красителя.
Смеси в пробирках многократно взбалтывают, затем дают отстояться и через 10-15 мин каждый раствор фильтруют через бумажный фильтр в чистые пробирки под теми же номерами. После фильтрации водных окрашенных растворов жидкость в пробирках №1 и №2 окажется бесцветной или окрашенной слабее, чем исходный раствор. Отметить, что в пробирке №3, где находился спиртовой раствор, окраска после фильтрации практически не изменится, т.е. адсорбция не происходит.
Фильтры №1 и №2 с содержимым перенести в фарфоровую чашку и добавить 2-5 мл спирта. Убедиться в том, что происходит десорбция красителя из адсорбента, а раствор окрашивается в соответствующий цвет. Результаты записать в рабочую тетрадь.
Аналогичные опыты проводят, используя в качестве адсорбентов мел (СаCO3), силикагель, кварцевый песок (SiO2), сухую глину, льнокостру. Сопоставляют полученные результаты с данными предыдущего опыта. В выводах дают объяснение полученным результатам.
8 . ИОННЫЙ ОБМЕН. ИОНИТЫ
Ионный обмен – это обратимая химическая реакция обмена ионами между адсорбентом (твердым веществом - ионитом) и раствором электролита. Процесс ионного обмена происходит в соответствие со следующими уравнениями:
ВН тв. + МеАn р-р → ВМе тв. + НАn р-р (8.1)
или
ВОН тв. + МеАn р-р → ВАn тв. + МеОН р-р (8.2)
где ВН и ВОН — твердые вещества (иониты) соответственно кислотной и основной природы, МеАn — свободная соль, ВМе — новая соль и НАn — новая кислота.
В результате протекания реакции (8.1) концентрация катионов водорода [H+] увеливается и раствор подкисляется (рН < 7). В ходе реакции (8.2) наоборот концентрация [H+] в растворе уменьшается, но увеличивается концентрация [OH-] и раствор становится более щелочным (рН > 7).
В соответствие с законом действующих масс для кислотной формы ионита можно записать уравнение для константы равновесия реакции ионного обмена:
К = [H+] р-р * [Me+] тв. / [Me+] р-р * [H+] тв.
Аналогичное уравнение можно записать для щелочной формы ионита:
К = [An -] тв. * [ОH -] р-р / [An-] р-р * [OH-] тв.
Знание константы равновесия ионного обмена необходимо для того, чтобы узнать, в какую сторону смещается равновесие реакции ионного обмена. В природе мы часто встречаемся с ионитами природного происхождения: древесина, целлюлоза, хлопковые и льняные волокна, цеолиты, глины, торф, органическое вещество почвы. Иониты бывают с волокнистой структурой — некоторые цеолиты (натролит, эдингтонит, сколецит, томсонит), глинный минерал аттапульгит (палыгорскит). Различают также аморфные иониты: аморфные алюмосиликаты (пермутиты), силикагель, стекла. Среди глинных минералов широко распространены вермикулит и вермикулитоподобные минералы почв, которые обладают высокой селективностью к ионам К+, NH4+, Rb+ и Cs+.
К синтетическим ионитам относятся ионнообменные пластмассы (смолы), которые делятся на две группы: катиониты и аниониты. Катиониты обменивают свои катионы на катионы солей жидкой фазы, а аниониты – на соответстующие анионы. Катиониты содержат в своем составе активные группы: SО3H– и СН2SO3H–, фенольные группы, ОН–, карбоксильные —СООН, остаток кремниевой кислоты —SiOOH и др. Аниониты содержат группы: –NH2, –NH–, –N≡. Каркас катионита имеет отрицательный заряд, а каркас анионита – положительный заряд.
Для количественной характеристики ионитов используют емкость обмена, которая характеризует суммарное количество противоионов (в эквивалентах) приходящееся на единицу массы сухого ионита. Максимальная емкость обмена теоретически должна точно соответствовать числу функциональных групп в ионите, способных к ионному обмену, однако на практике это не достигается из-за наличия стерических и кинетических факторов (размеры иона, высокая степень сшивки, малый диаметр пор и т.д.).
Экспериментально емкость обмена определяют, обрабатывая ионит раствором электролита избыточной концентрации с последующей отмывкой избыточного количества электролита растворителями.
Почвы, глины и грунты характеризуются меньшей емкостью обмена по сравнению с синтетическими ионитами.
Как правило, для сильнокислотных и сильноосновных ионитов емкость практически не зависит от природы, концентрации и рН насыщающего раствора (рис. 26).
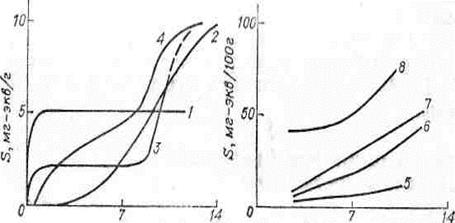
рН рН
Рис. 26. Зависимость емкости обмена некоторых катионитов от рН
1 - монофункциональный катионит с сильнокислотными сульфогруппами; 2 - монофункциональный ионит с карбоксильной группой; 3 - бифункциональный катионит с сильнокислотной сульфогруппой и очень слабокислотной фенольной группой; 4 - катионит с фосфорнокислотной бифункциональной группой; 5 - каолин; 6, 7 - почвы; 8 - монтмориллонит (по Ю.А. Кокотову, 1980)
Более сложно протекает ионный обмен на слабокислотных и слабоосновных ионитах. Для них емкость обмена от кислотности раствора (рН), общей концентрации и природы противоионов в растворе, что связано, в первую очередь, с изменением степени диссоциации функциональных групп (рис. 26, кривая 2). У природных ионитов в сильнокислой и сильнощелочной среде происходит частичное разложение алюмосиликатной основы, что влияет на показатели измерений емкости. Для природных ионитов емкость характеризуют величиной при определенном значении рН (например, для почв рН = 6,4 или рН = 7).
При использовании ионитов для разделения компонентов смеси применяют понятия избирательности и степени извлечения компонента. Например, для сравнения избирательности сорбции ионов и степени извлечения иона из раствора используют следующий прием. Сорбент в равновесных условиях обогащают этим компонентом (ионом) по сравнению с раствором. Мерой обеднения или обогащения сорбента является коэффициент распределения Кр (частное от деления):
Кр = [Men+]сорбент / [Men+]р-р
где [Men+]сорбент - концентрации компонента (иона) в сорбенте, [Men+]р-р - концентрация компонента (иона) в растворе. При Кр < 1 сорбент обеднен компонентом, а при Кр > 1 - обогащен компонентом (ионом) по сравнению с раствором.
На практике, как правило, отделяют один ион от других ионов раствора, т.е. происходит обогащение ионита этим ионом и обеднение другими присутствующими ионами. Для оценки избирательности (селективности) используют коэффициент избирательности Кизб равный отношению коэффициентов распределения конкурирующих ионов.
Кизб = КрI/ КрII
Верхний индекс (I и II) относится к первому и второму ионам. При Кизб > 1 ионит избирателен к иону I по сравнению с ионом II, а при Кизб< 1 из раствора избирательно сорбируется ион II. При Кизб = 1 ионит не обладает селективностью ни к одному из ионов, и разделить эти ионы невозможно в данных условиях. При малых значениях Кизб используют различные технические приемы, например, удлиняют разделительную колонну, наполненную ионитом, а также с помощью различных вариантов хроматографического метода разделяют ионы с относительно малой разницей в избирательности.
Иониты часто проявляют высокую избирательность по отношению к какому-нибудь одному иону или к группе близких по свойствам ионов по сравнению с многими другими, т.е. наблюдается так называемая специфичность ионита. Это явление, как правило, связано с особенностями химического взаимодействия данного иона или группы ионов с ионитом. Специфичность ионита позволяет эффективно выделять из раствора необходимые ионы.
Биологическое значение
Иониты находят широкое применение во многих отраслях промышленности и сельского хозяйства. Их используют для полной деминерализации природных вод, очистки сточных и загрязненных вод, минеральных и синтетических масел, горючего, сахарного сиропа, плодово-ягодных соков, вина, приготовления лекарственных препаратов, выделения или концентрирования редких металлов (никеля, кобальта, меди, сурьмы, мышьяка, золота, молибдена, вольфрама, свинца, цинка и др.), в различных технологических процессах в химической промышленности, в ядерной энергетике при выделении, очистке и переработке сырья для ядерных реакторов, разделении радиоактивных продуктов ядерных реакций и получении чистых радиоактивных изотопов;
Например, при помощи ионитов проводят разделение аминокислот на группы и выделение чистых препаратов. В основе этого метода лежат следующие уравнения:
для катионитов
RH + NH2CHR’COOH ↔ RNH3CHR’COOH
и для анионитов
RNH2*HX + HZ ↔ RNH2HZ + HX
где RNH2- HX — анионит; HZ — аминокислота.
К крупным потребителям ионитов относится пищевая промышленность и сахароварение, где ионный обмен используют для получения и очистки лимонной, молочной, яблочной, щавелевой и других органических кислот из природного сырья; обесцвечивания сахарных сиропов, умягчения соков. Не обойтись без ионитов в космосе, а также в различных замкнутых системах, например, в подводных лодках, где необходимо очищать и осушать воздух, перерабатывать отходы жизнедеятельности человека, выращивать растения на искусственных почвах.
Важную роль играет ионный обмен в процессах минерального питания растений. Большинство природных ионитов (глины, гуминовые и многие другие вещества неорганического и органического происхождения) находится в коллоидном состоянии.
Для ряда электрохимических процессов, производства щелочей и хлора, электродиализа, обессоливания морской воды, выпуска аккумуляторов и т.п., широко применяют ионообменные мембраны из ионитов в форме тонких пластин. В состав гетерогенных мембран входит порошок ионита и связующее (полиэтилен, каучук, поливинилхлорид т.п.). Состав гомогенных мембран однороден и состоит из ионообменной смолы, которую в некоторых случаях армируют химически инертной сеткой из ткани или стекловолокна. Мембраны обладают меньшей обменной емкостью по сравнению с ионообменными смолами, они слабо набухают в воде и стабильно сохраняют размеры мембран.
Ионный обмен в биологических системах изучают давно. Ионоообменными свойствами обладают корни растений, где на поверхности корневых волосков происходит обмен ионов металлов с выделяемыми корнями ионами водорода. Этот процесс лежит в основе сложного процесса поглощения ионов из почвы растениями. Экспериментально доказано, что корень растения ведет себя как водородный электрод и его электрический потенциал изменяется с изменением рН питательного раствора в соответствии с уравнением Нернста.
Ткани растений при нормальных условиях также обладают катионообменными свойствами. Величина обменной емкости может составлять от 1 до 40 мг-экв/100 г, а изолированных оболочек растительных клеток — 12-26 мг-экв/100 г. Ионообменными свойствами обладают структурные элементы растительных клеток (митохондрии, пластиды и т.п.). Установлена амфотерность многих структурных элементов, перезарядка которых и переход к анионному обмену происходит в слабокислой среде (рН = 3-4).
Катионообменные свойства этих структур обусловлены наличием в основном карбоксильных и фосфорнокислыехгрупп, анионообменные — аминогруппами белков. В ионообменных процессах растений и живых организмах важна роль процессов комплексообразования (хелатообразования) с участием карбоксильных, амино- и имидазольных групп.
Ионный обмен — важная часть сложных биохимических механизмов. Так у многих ферментов свойства каталитического центра определяются находящимся в нем катионом (металлоферменты), либо анионом. Эти ионы удерживаются электростатическими силами, координационными связями и способны к обмену на другие ионы. При замене одних ионов на друние меняется структура и свойства каталитического центра, что приводит к ослаблению или полной потере каталитических свойств фермента. Аналогичный эффект наблюдается при изменении рН раствора, влияющем на диссоциацию функциональных групп белковых цепей фермента и на форму молекулы белка в целом. По этой причине ферменты действуют лишь в определенном интервале рН.
В биологических мембранах ионный обмен осуществляется как за счет диффузии, так и против градиента концентраций. Переносят ионы через мембрану белки, обладающие в различных состояниях неодинаковой селективностью к обменивающимся ионам (в случае так называемого «натриевого насоса» — к ионам Na+ и К+). Состояние белка-переносчика может изменяться за счет взаимодействия в клетках с молекулами аденозинтрифосфата.
На основе ионообменной адсорбции русским химиком М.С. Цветом разработан метод хроматографического анализа, при помощи которого проводят исследования аминокислотного состава пищевых продуктов.
Вопросы для самоконтроля
1. К какому типу реакций относится реакция ионного обмена.
2. Запишите константу равновесия реакции ионного обмена для катионита и анионита.
3. Какие катионы будут предпочтительнее поглощаться катионитами: одно-, двух- или трехзарядные?
4. Если катионы имеют одинаковый заряд, то какие из них в зависимости от радиуса иона будут предпочтительнее поглощаться катионитами: Na+ или K+, Mg2+ или Ca2+, Al3+ или Fe3+?
5. Какие существуют типы ионитов?
6. Чем отличаются по составу катионитов от анионитов?
7. Что такое коэффициент распределения, и каков его физический смысл?
8. Каков физический смысл коэффициента избирательности?
9. В каких областях промышленности используют ионный обмен?
Экспериментальная часть








