Изотерма адсорбции по Ленгмюру. В 1917 году Ленгмюр предложил более удобное уравнение адсорбции, которое выведено им на основании молекулярно-кинетической теории газов.
Изотерма адсорбции по Ленгмюру является уравнением гиперболы и может быть представлена в виде:
Г = Г ¥ × 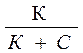
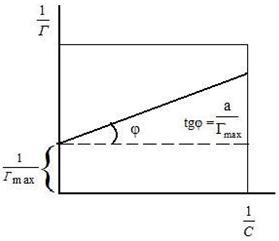
где Г – величина адсорбции на единицу поверхности; Г¥ ‒ предельное количество вещества, адсорбированного единицей поверхности при полном насыщении поверхности; С – равновесная концентрация. В уравнении Ленгмюра также имеются две константы ‒ Г¥ и К. Графическое изображение изотермы адсорбции Ленгмюра представлено на рисунке 16 и 17.
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Молекулы адсорбата поглощаются лишь на отдельных точках поверхности адсорбента. Эти точки – активные центры – обладают остаточными валентностями и способны связывать только одну молекулу адсорбата. Заполнение всех активных центров соответствует насыщению поверхности. Таким образом, насыщенный адсорбционный слой мономолекулярен, т.е. только один слой молекул связан силами молекулярного сцепления с поверхностью. На твердой поверхности при постоянной температуре устанавливается подвижное равновесие между молекулами, адсорбирующимися на поверхности, и молекулами, отрывающимися от поверхности. Концентрация адсорбата на момент установления динамического адсорбционного равновесия называется равновесной. Следовательно, активные центры удерживают адсорбированные молекулы только в течение определенного промежутка времени.
 | |||
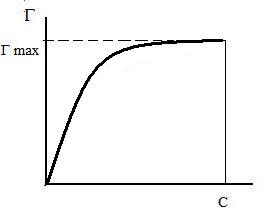 | |||
Рис. 16. Изотерма адсорбции по Ленгмюру Рис. 17. Графическое определение постоянных адсорбции уравнения Ленгмюра
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Однако адсорбция может быть и многослойной, тогда уравнение изотермы адсорбции Ленгмюра становится неприменимой, более точными являются так называемые S-образные изотермы БЭТ (по фамилиям ученых Браунер, Эммет, Теллер), одна из которых представлена на рисунке 18.
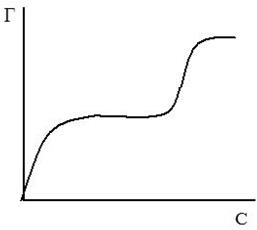 |
Рис.18. S-образная изотерма БЭТ
Изотерме адсорбции Ленгмюра соответствует только нижняя часть (ОА) кривой. S-образные изотермы и соответствующие им уравнения особенно часто используются для случаев адсорбции паров на твердых поверхностях.
Практическое значение явлений адсорбции. Явления адсорбции находят широкое применение в промышленности, технике, биологии, медицине, ветеринарии. Так, например, с адсорбционными процессами мы встречаемся в химической и пищевой промышленности при сахароварении, очистке соков и вин, при ректификации спирта, в текстильной промышленности при крашении тканей.
Среди различных адсорбентов одно из первых мест занимает уголь. Древесный, костяной, кровяной и другие сорта углей получили широкое распространение как адсорбенты в самых различных областях.
Адсорбция широко используется в медицине с лечебными целями. Адсорбенты способны связывать многие ядовитые вещества, поэтому многие коллоиды применяют в качестве противоядий. Так, например, коллоидное железо употребляется при мышьяковом отравлении. Для этих же целей употребляются различные мелко растертые порошки, чаще всего животный и древесный уголь.
Явления адсорбции имеют большое биологическое значение. В организме имеется огромное количество поверхностей, на которых идут адсорбционные процессы. Это, во-первых, поверхности раздела между организмом и средой, затем поверхности стенок сосудов, разнообразнейшие мембраны, поверхности клеток, поверхности ядер, поверхности вакуолей и, наконец, поверхности коллоидных частиц протоплазмы. На всех этих поверхностях в процессе обмена веществ могут адсорбироваться различные вещества.
Если для высших организмов поверхность раздела между организмом и средой адсорбционной роли почти не играет, то для организмов, живущих в воде, особенно для низших организмов, эта поверхность имеет весьма существенное значение в процессах питания и проникновения пищевых веществ.
По исследованиям Траубе поверхностно-активные вещества легко проникают в клетку, а пищевые вещества, как правило, поверхностно-активны. Поэтому, первым этапом усвоения, является адсорбция питательных веществ, после чего начинается процесс химического превращения.
Процессы обмена веществ в организме осуществляются посредством разнообразных специфических катализаторов-ферментов, являющихся коллоидами. Первые стадии действия фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Явления адсорбции широко распространены в жидкостях и тканях организма. Такие важные жизненные процессы как, питание, дыхание, выделение и другие процессы жизнедеятельности организма сопровождаются многообразными явлениями адсорбции.
Таким образом, если учесть огромнейшие величины поверхностей раздела у высших организмов и адсорбционные возможности этих поверхностей, то будет понятно все то значение, которое имеет адсорбция в процессах жизнедеятельности.
2. Поверхностное натяжение.
Молекулы, находящиеся на поверхности отличаются по силам молекулярного притяжения от молекул, находящихся внутри жидкости. Дело в том, что молекулы в объёме жидкости равномерно окружены такими же молекулами и поэтому их силовые поля скомпенсированы. Поверхностные же молекулы, взаимодействуют как с молекулами одной фазы (жидкость), так и с молекулами другой фазы (газ), в результате чего равнодействующая молекулярных сил в поверхностном слое не равна нулю и направлена внутрь той фазы, с которой взаимодействие больше.
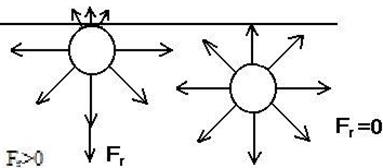 |
Рис. 19.Схема действия межмолекулярных сил внутри жидкости и на ее поверхности.
Особенно велика равнодействующая сила, если одной из фаз является газ (собственный пар): молекулы в газе чрезвычайно удалены друг от друга, интенсивность молекулярных сил со стороны газа очень мала.
Нескомпенсированность молекулярных сил приводит к тому, что поверхностные молекулы обладают большей свободной энергией, чем молекулы внутри фаз (рис.19). Следовательно, чтобы переместить молекулы из глубины фазы на поверхность, необходимо совершить работу против равнодействующей силы, т.е. образование новой поверхности раздела фаз требует совершения работы. Величина работы, отнесенная к единице поверхности 1см2 и выраженная в эрг/см2, получила название поверхностного натяжения:
- d А = d G = s d S
где dА – затраченная работа, dG –приращивание свободной энергии при увеличении поверхности на dS; s - поверхностное натяжение, являющееся мерой нескомпенсированности межмолекулярных сил в поверхностном (межфазном) слое.
Единица поверхностного натяжения [s] = 1 Дж/м2 = 1 Н/м; в литературе можно встретить и внесистемную единицу [s] = 1 эрг/см2 = 1 дин/см.
Поверхностное натяжение определяется силами межмолекулярного взаимодействия жидкости: чем они интенсивнее, тем больше равнодействующая поверхностных сил и тем больше s. Например, между атомами ртути действуют очень интенсивные металлические связи (разновидность химических сил) – нескомпенсированность сил в поверхностном слое велика и s ртути при комнатной температуре превышает поверхностное натяжение всех известных жидкостей и равно 470×10-3 Дж/м2. Напротив, между молекулами предельных углеводородов действуют очень слабые дисперсионные силы (составляющие сил Ван-дер-Ваальса) - s таких жидкостей мала. Например, поверхностное натяжение гексана при 200С равно 18,46×10-3 Дж/м2.
Стремление системы к уменьшению свободной энергии, кроме сокращения поверхности раздела фаз реализуется снижением поверхностного натяжения вследствие процессов адсорбции, адгезии, смачивания и др.
Связь между адсорбцией веществ и поверхностным натяжением установил Гиббс:
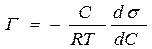
где R ‒ универсальная газовая постоянная, С – концентрация адсорбата, Т ‒ абсолютная температура, ºК, 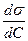 - поверхностная активность.
- поверхностная активность.
Из этого уравнения следует важный вывод. Измерения адсорбции на твердых адсорбентах обычно производят по убыли концентрации адсорбата в растворе (DC). Поверхность адсорбента, как правило, невелика и DC составляет лишь несколько процентов от самой концентрации. Поэтому для получения достоверных значений Г необходимо измерять концентрации с очень большой точностью. В отличие от этого, измерения адсорбции на поверхности жидкость - газ крайне просты. Они сводятся к изучению зависимости поверхностного натяжения от концентрации адсорбата, графическому дифференцированию кривой s = f(C) и расчету Г по уравнению Гиббса.
Работами Ленгмюра, Харкинса, Шишковского было установлено, что все вещества по их действию на поверхностное натяжение жидкостей можно разделить на два класса: поверхностно - активные и поверхностно - инактивные.








