6. Кондуктометрическое титрование
Кондуктометрическое титрование является методом объемного анализа, в котором индикатором является электропроводность раствора. Из этого следует, что данный метод может быть применен только для растворов, проводящих электрический ток. Преимущество метода кондуктометрического титрования заключается в том, что с помощью этого метода представляется возможным анализ мутных или окрашенных растворов, коллоидных систем, суспензий и т.д. (растительные соки, почвенные растворы, сыворотка крови, слюна, молоко и т.д.), для которых непригодны колориметрические методы исследования. Кондуктометрическое титрование возможно в присутствии окислителей и восстановителей, ограничивающих использование индикаторов.
Кондуктометрическое титрование обладает высокой чувствительностью - концентрации титруемых растворов могут достигать 10-4 моль/л и меньше. Относительные ошибки определений при кондуктометрическом титровании индивидуальных веществ составляют ±1 %, при титровании смесей – до ± 2 %.
Согласно основному уравнению электропроводности:
1000c = Сi( 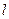 k +
k + 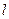 a),
a),
где: c - удельная электропроводность раствора, Сi - ионная (молярная) концентрация раствора, 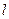 k и
k и 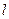 a - электролитические подвижности катиона и аниона.
a - электролитические подвижности катиона и аниона.
Удельная электропроводность прямо пропорционально связана с Ci и 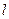 ионов. Если в ходе титрования меняется хотя бы одна из этих величин не менее чем на 10 %, то индикатором может служить электропроводность раствора и кондуктометрическое титрование может быть применено.
ионов. Если в ходе титрования меняется хотя бы одна из этих величин не менее чем на 10 %, то индикатором может служить электропроводность раствора и кондуктометрическое титрование может быть применено.
Для этого титрования необходимо выбрать соответствующие реагенты, которые могли бы использоваться для проведения одной из следующих типов химических реакций, проводимых кондуктометрически:
1. осаждения
2. комплексообразования
3. окисления-восстановления
4. кислотно-основного взаимодействия.
При этом другим условием применения кондуктометрического метода является изменение Ci или 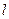 иона. Например, при титровании по типу реакций осаждения это может быть только изменение
иона. Например, при титровании по типу реакций осаждения это может быть только изменение 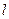 иона, т.к. реакции осаждения идут по типу обменных реакций, и значит Ci изменяться не может - какое количество ионов было в реагенте, такое количество ионов остается в продуктах.
иона, т.к. реакции осаждения идут по типу обменных реакций, и значит Ci изменяться не может - какое количество ионов было в реагенте, такое количество ионов остается в продуктах.
Например, возможно ли кондуктометрически титровать сульфат-ион? Если да, то чем можно провести такое титрование?
Для решения этой задачи сначала выбираем по какому из перечисленных ранее типов реакций возможно провести такое титрование. Например, мы решили проводить ее по типу реакций осаждения. По таблице растворимости солей (см. приложение таблица 3) видим, что SO2-4 ‒ион образует нерастворимые соединения с катионами Ba2+ и Pb2+, т.е. титровать наш раствор можно растворимыми солями бария или свинца, например BaCl2, Ba(NO3)2, (CH3COO)2Ba:
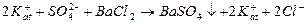
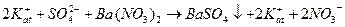
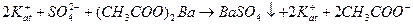
где: 1) 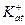 в уравнении обозначают катионы, которые находятся в титруемом растворе в паре с сульфат -ионом, они могут состоять из различных сортов ионов, например К+, Na+, Fe2+ (все растворимые соли, катионы которых не взаимодействуют с анионами титранта), но это не отражается на возможности метода, т.к. в процессе титрования их концентрация не меняется;
в уравнении обозначают катионы, которые находятся в титруемом растворе в паре с сульфат -ионом, они могут состоять из различных сортов ионов, например К+, Na+, Fe2+ (все растворимые соли, катионы которых не взаимодействуют с анионами титранта), но это не отражается на возможности метода, т.к. в процессе титрования их концентрация не меняется;
2) в титруемом растворе находятся ионы Kat+ и 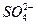 , они обеспечивают электропроводность раствора, поэтому титруемый раствор изображен в ионном виде; титрант (ВаСl2 и др.) изображен в молекулярном виде, как показатель того, что он не влияет на электропроводность раствора, т.к. еще не находится в растворе.
, они обеспечивают электропроводность раствора, поэтому титруемый раствор изображен в ионном виде; титрант (ВаСl2 и др.) изображен в молекулярном виде, как показатель того, что он не влияет на электропроводность раствора, т.к. еще не находится в растворе.
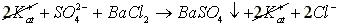 |
Находим подобные в обеих частях уравнения химической реакции (их подчеркиваем черточкой) и уничтожаем, как величины, вносящие равный вклад в левой и правой частях уравнения:
Таким образом, из оставшейся части химической реакции видно, что в процессе титрования концентрация Ci, не изменяется, а один двухзарядный ион замещается на два однозарядных и потому заряд, переносимый ионами, одинаков.
Значит, электропроводность титруемого раствора зависит только от подвижности ионов. Из таблицы 22 находим подвижности ионов при н.у.: 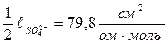 ;
; 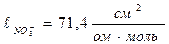 ;
; 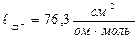 ;
; 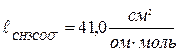 .
.
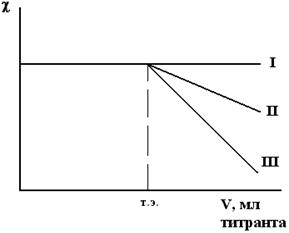
Если в процессе реакции один ион заменяется на другой, имеющий примерно равную подвижность ( 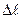 <10 %), то в процессе титрования не будет наблюдаться заметного изменения электропроводности (рис. 13а, I), как это происходит при титровании сульфат -иона хлоридом бария:
<10 %), то в процессе титрования не будет наблюдаться заметного изменения электропроводности (рис. 13а, I), как это происходит при титровании сульфат -иона хлоридом бария:
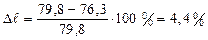
|
| Рис. 13а. Изменение c при титровании сульфат-иона: I – BaCl2, II- Ba(NO3)2, III – Ba(CH3COO)2. |
При титровании сульфат-иона нитратом бария:
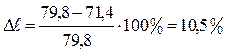
Эта величина более 10%, значит излом (изменение электропроводности) на кривой титрования заметен (рис.13а, II).
Еще большие изменения электропроводности происходят при титровании сульфат-иона уксуснокислым барием:
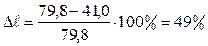
В этом случае изменение электропроводности еще больше и излом на кривой титрования еще заметнее (рис. 13а, III). Точка излома кривой является точкой эквивалентности.
Рассмотрим ряд кондуктометрических кривых, характерных для реакций кислотно-основного взаимодействия. До начала титрования раствор сильной кислоты имеет высокую c, поскольку при диссоциации кислоты в растворе образуются ионы водорода, имеющие высокую электролитическую подвижность. В процессе титрования ионы водорода связываются ионами гидроксила основания с образованием малодиссоциирующего соединения (Н2О), согласно реакции:
H+ + Cl‒ + Na+ +OH‒ → H2O + Na+ + Cl‒
Их место занимают малоподвижные ионы Na+. В результате электропроводность титруемого раствора будет уменьшаться вплоть до точки эквивалентности. В точке эквивалентности электропроводность обусловлена ионами Na+ и Cl- образовавшейся соли и будет минимальной, поскольку электролитическая подвижность Na+ на порядок меньше электролитической подвижности Н+. При дальнейшем добавлении основания в растворе появляются высокоподвижные ОН- и электропроводность раствора увеличивается (рис.13 б, I).
В случае титрования слабой кислоты сильным основанием (рис. 13 б, II) реакция протекает по уравнению:
CH3COOH + CH3COO- + H+ + NaOH ® CH3COO- + Na+ + H2O
До начала титрования электропроводность раствора обусловлена Н+ и СН3СОO- диссоциированной кислоты. Количество ионов невелико, т.к. степень электролитической диссоциации СН3СООН очень мала (при C £ 0,1 моль/л, a »1,5 %), поэтому в уравнении химической реакции уксусная кислота записана в молекулярном и ионном видах.
Таблица 22
Подвижности ионов ( l ¥ ) при бесконечном разведении (катионы)
| Ионы | Температура, ОС | Ионы | Температура, ОС | ||||||
| 0 | 18 | 25 | 100 | 0 | 18 | 25 | 100 | ||
| H+(H2O) Li+ Na+ K+ Rb+ Cs+ NH4+ ½ Be++ ½Mg++ ½ Ca++ ½ Sr++ ½ Ba++ ½ Ra++ 1/3Al3+ | 225 19,1 25,9 40,3 - 44,0 40,3 - 28,5 30,8 31,0 33,6 33,0 29,0 | 315 33,4 43,5 64,6 67,5 68,0 64,0 - 45,0 51,0 51,0 55,0 56,6 - | 349,7 38,7 50,1 73,5 77,5 76,8 73,7 45,0 53,1 59,5 59,5 63,7 66,8 63,0 | 637 120 150 200 - 200 184 - 170 187 - 200 - - | 1/3Sc3+ 1/3Ce3+ 1/3Cr3+ ½ Mn++ ½ Fe++ 1/3Fe3+ ½ Co++ ½ Ni++ ½ Cu++ Ag+ ½ Zn++ ½ Cd++ Tl+ ½ Pb++ | - - - 27 28 - 28 28 20 33 28 28 43 38 | - - - 44 44 - 45 45 45 54 45 45 66 60 | 64,7 67,0 67,0 53,5 53,5 68,0 54,0 54,0 56,0 61,9 53,5 54,0 74,9 70,0 | - - - - - - - - - 180 - - - - |
Анионы
| Ионы | Температура, ОС | Ионы | Температура, ОС | ||||||
| 0 | 18 | 25 | 100 | 0 | 18 | 25 | 100 | ||
| OH- F- Cl- ClO2- ClO3- ClO4- Br - BrO3- J- JO3- JO4- SH- SO3H- ½ SO32- ½ SO42- ½ S2O82- SCN- | 105 - 41,4 - 36,0 37,3 41,3 31,0 42,0 21,0 - 40,0 27,0 - 34,0 - 41,7 | 174 46,6 65,5 - 55,0 59,1 67,6 49,0 66,5 33,9 49,0 57,0 - - 68,3 - 56,6 | 200 55,4 76,3 52,0 64,0 68,0 78,4 56,0 76,9 41,0 55,6 65,0 50,0 72,0 79,8 86,0 66,5 | 446 - 207 - 172 179 - 155 - 127 - - - - 256 - - | ½SeO42- N3- NO2- NO3- NCO- PO4H2- ½PO4H2 AsO4H2 CO3H- ½CO32 CN- ½ CrO42 MnO42- HCOO- CH3COO ½(C2O4)2- | - - 44,0 40,2 - - - - - 36,0 - 42,0 36,0 - 20,0 32,0 | 65,0 - 59,0 61,7 54,8 28,0 - - - 60,5 - 72,0 53,0 47,0 34,0 63,0 | 75,7 69,5 72,0 71,4 64,6 36,0 57,0 34,0 44,5 72,0 78,0 85,0 62,8 - 41,0 - | - - 189 - - - - - - - - - - - 130 - |
Увеличение электропроводности раствора до точки эквивалентности объясняется полной диссоциацией образующейся соли по сравнению с диссоциацией слабой кислоты, в результате чего возрастает общая ионная концентрация раствора. При добавления избытка основания, после точки эквивалентности, в растворе появляются высокоподвижные ОН- и электропроводность раствора значительно увеличивается.
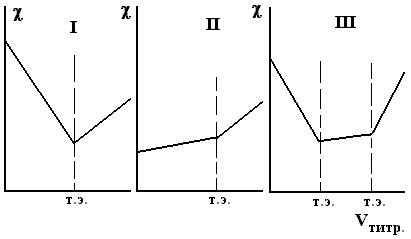
Рис.13 б. Кривые кондуктометрического титрования сильной кислоты (I), слабой кислоты (II), смеси сильной и слабой кислот (III) сильным основанием
Кривая (рис.13 б,III) демонстрирует изменение электропроводности при титровании смеси сильной и слабой кислот сильным основанием. Совместная нейтрализация сильной кислоты и кислоты средней силы (1 £ pK £ 3) не позволяет проводить их дифференцированное титрование. Только в тех случаях, когда рК слабой кислоты достигает четырех, возможно титрование слабой кислоты в присутствии сильной. На кривой видны два излома – первый соответствует точке эквивалентности сильной кислоты, второй излом показывает точку эквивалентности слабой кислоты. После полной нейтрализации кислот прибавление щелочи увеличивает электропроводность раствора из-за появления в нем высокоподвижных ионов гидроксила и увеличения общей концентрации раствора. Определив графически точки эквивалентности, рассчитывают молярность кислот.
Экспериментальная часть
Задание. Определение концентрации кислоты
В коническую колбe емкостью 300 мл пипеткой наливают определенный объем кислоты (по заданию преподавателя), вставляют электроды и разбавляют кислоту дистиллированной водой до погружения электродов в раствор.
При включении реохордного моста Р-38 зажигается сигнальная лампочка. Переключатель “питание” устанавливают в положение “~”. Переключатель плеча сравнения устанавливают в положение “установка нуля”, а переключатель, расположенный на корпусе гальванометра, - в положение “точно”. Вращением рукоятки корректора, расположенного на корпусе гальванометра, устанавливают стрелку гальванометра на нуль. После этого приступают к измерению начального сопротивления титруемого раствора. Для этого ручкой реохорда устанавливают стрелку гальванометра на нуль при сопротивлении магазина “1000” или “10000”. Сопротивление магазина и отсчет на лимбе (m) реохорда заносят в табл.6 б. Титрование раствора щелочью проводят, добавляя её по 1 миллилитру. После добавления каждого миллилитра щелочи раствор тщательно перемешивают и затем измеряют его сопротивление. Если сопротивление раствора возрастает настолько, что с помощью реохорда нельзя вывести стрелку гальванометра на нуль, устанавливают другое сопротивление магазина. Титрование продолжают до тех пор, пока показание на лимбе реохорда не станет равным 0,3 – 0,4 при сопротивлении магазина “1000”. Все данные заносят в таблицу 23.
Таблица 23
Результаты кондуктометрического титрования
| V мл, NaOH | Rсравн., Ом | m | Rx, Ом | c, Ом/см |
где Rсравн – сопротивление магазина (1, 10, 1000, 10000 ом), m – точка компенсации, Rx – сопротивление раствора.
Рассчитывают c раствора:
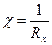
По полученным данным строят кривую титрования в координатах Vтитранта ‒ c и рассчитывают молярность кислоты:
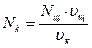 .
.
Делают выводы по проделанной работе.








