П отенциометрическое титрование кислот
Для потенциометрического титрования кислот в качестве индикаторного электрода применяется стеклянный электрод с Н-функцией:
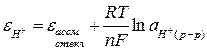
Гальваническая цепь тогда запишется следующим образом:
Ag|AgCl, HCl (0,1 M)| стекл. | H+x |KCl, AgCl | Ag
мембр. исслед. (нас.)
р-р
В процессе потенциометрического титрования кислот щелочами происходит уменьшение концентрации Н+-ионов вследствие образования малодиссоциированного соединения – Н2О:
H+ + Cl- + NaOH à H2O + Na+ + Cl-
Следовательно, уменьшается величина eстекл., Е, CН+ (рН).
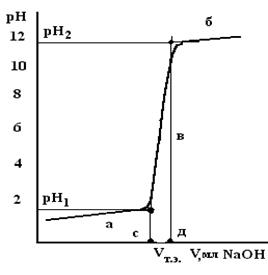
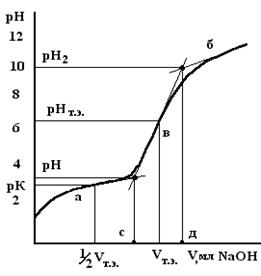
Особенно велико изменение рН при титровании НСl, HNO3 и других сильных кислот (рис.7). При титровании CH3COOH и других слабых кислот изменение рН гораздо меньше (рис.8).
Для получения кривой потенциометрического титрования проводят два титрования исследуемого раствора: а) предварительное и б) точное.
Перед началом титрования проводят настройку прибора (см. работу № 3 – буферные системы, задание 2).
Задание 1. Определить концентрации, основности и силы кислот
титрованием NaOH
1. Предварительное титрование
| 
|
| Рис.7. Кривая потенциометрического титрования сильной кислоты | Рис. 8. Кривая потенциометрического титрования слабой кислоты. Графическое определение точки эквивалентности и константы диссоциации |
Ополоснув электроды и стаканчик для титрования дистиллированной водой, в стаканчик наливают определенное количество (по заданию преподавателя) неизвестной кислоты неизвестной концентрации. Следят, чтобы шарик стеклянного электрода полностью был покрыт раствором. Определяют рН исходного раствора и результат записывают в таблицу 15. Приливают из бюретки 1 мл NaOH, перемешивают титруемый раствор осторожными круговыми движениями стаканчика и определяют рН. Далее поступают подобным образом, каждый раз добавляя по 1 мл NaOH до тех пор, пока от добавления 1 мл NaOH рН раствора не изменится на 4…7 единиц. Это ориентировочная (приблизительная) точка эквивалентности. Добавив еще 5 - 7 раз по 1 мл NaOH и убедившись в правильности найденного ориентировочного объема NaOH, предварительное титрование заканчивают и приступают к точному титрованию.
Таблица 15
1. Предварительное титрование
| Прибавлено щелочи, мл | рН | Ориентировочная точка эквивалентности |
| 1 2 и. т.д. |
2. Точное титрование
Ополоснув дистиллированной водой стаканчик, наливают в него такой же объём кислоты, как и при предварительном титровании. Определяют рН исследуемого раствора. Приливают щелочь по 1 мл, перемешивая каждый раз раствор, до объема на 1 мл меньше, чем объём щелочи в ориентировочной точке эквивалентности. Каждый раз измеряют рН и результаты заносят в таблицу 16. Затем приливают щелочь по 0,2 мл до резкого изменения рН на 4…7 единиц. Результаты также записывают в таблицу. Добавляют еще по 1 мл щелочи 5 - 7 раз (до рН » 12) и на этом точное титрование заканчивают.
На основании полученных данных точного титрования строится график, где по оси абсцисс откладывается объем добавленной щелочи (в мл), по оси ординат – соответствующее значение рН (см. рис. 8 - 9).
Таблица 16
Точное титрование
| Прибавлено щелочи, мл | рН | Объём щелочи в точке эквивалентности | Характеристика кислоты | |||
| Молярность | Сила | Основность | Константа диссоциации, К | |||
| 0 1 2 и т.д. | ||||||
Графически определяют объем NaOH в точке эквивалентности. Для этого проводят прямые линии по большинству точек в кислой (а), щелочной (б) областях и в области наибольшего скачка рН (в). Из точек их пересечения опускают на ось абсцисс перпендикуляры. Точка эквивалентности находится на середине отрезка, отсекаемого на оси абсцисс и заключенного между этими перпендикулярами. Это и будет объем NaOH в точке эквивалентности. Концентрацию (Ск) титруемой кислоты вычисляют по уравнению:
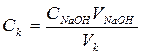
По количеству скачков титрования определяют основность титруемой кислоты. Каждый скачок соответствует одной ступени диссоциации кислоты. Так, например, HCl соответствует один скачок при титровании, серной – два и т.д.
По кривой потенциометрического титрования определяют силу кислоты. Если скачок титрования 7 £ DрН £ 10, то титруемая кислота сильная, если скачок титрования равен 3 £ DрН £ 5, то титруемая кислота – слабая. Для слабой кислоты характерен нерезкий, довольно плавный скачок, для сильной – резкий. Кроме того, если титруется разбавленная слабая кислота с концентрацией 0,01 М £ С £ 0,1 М, то у нее исходный рН » 2,5 - 3 и более, в то время как для сильной кислоты такой же концентрации величина рН » 1 - 2.
Мерой силы слабых кислот является константа их электролитической диссоциации К. Константа электролитической диссоциации слабых кислот определяется по кривой титрования следующим образом.
При титровании слабой кислоты образуется смесь этой кислоты с её солью. Такая смесь, например CH3COOH + CH3COONa, является буферным раствором, рН которого определяется по уравнению буферного раствора:
рН = рК + lg [соль] – lg [кислота],
где рК – отрицательный логарифм константы электролитической диссоциации, [соль] = Сс Vc – действующая масса соли в растворе, [кислота] = Ca Va - действующая масса кислоты в растворе.
По графику на оси абсцисс находят объем щелочи в точке эквивалентности Vт.э. Из середины этого отрезка, т.е. из точки с координатой ½Vт.э, восстанавливают перпендикуляр до пересечения с кривой нейтрализации. Так как в точке с координатами ½Vт.э концентрация неоттитрованной еще кислоты равна концентрации образовавшейся соли, т.е. [соль] = [кислота], то, согласно уравнению буферных растворов, в этой точке рН = рК.
Чтобы найти численное значение рК, из точки пересечения кривой нейтрализации с перпендикуляром, восстановленным с оси абсцисс из точки ½ Vт.э, опускают перпендикуляр на ось ординат (ось рН). Полученное значение рН будет равно рК данной кислоты. По величине рК вычисляют константу электролитической диссоциации. Результаты записывают в таблицу 16.
На основе полученных данных (количество скачков титрования, величина скачка титрования, константа электролитической диссоциации) делают заключение о характере оттитрованной кислоты.








