Задание 5. Определение буферной емкости буферного раствора
по кислоте или щелочи
Измерить рН полученного от преподавателя буферного раствора (объёмом 20 мл). Прибавить к нему из бюретки 1 мл 0,1М раствора NaOH или 0,1М раствора HCl в зависимости от того, определяется буферная емкость по кислоте или по щелочи (по заданию преподавателя), стаканчик приподнять и осторожно и тщательно размешать содержимое. Измерить рН и записать полученный результат в таблицу 13.
Таким путём прибавлять к исследуемому раствору по 1 мл кислоты или щелочи до изменения его рН приблизительно на единицу по сравнению с начальным значением рН. Вычислить общий объём прибавленного реактива и соответствующее изменение рН (DрН) буферного раствора. Вычислить буферную емкость по формуле:
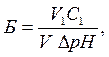
где Б – буферная емкость по кислоте или щелочи; С1 – концентрация кислоты или щёлочи; V1 – объём прибавленного раствора кислоты или щелочи, мл; V – объём буферного раствора, взятый для исследования, мл; DрН – разность значений рН до и после прибавления кислоты или щёлочи (берётся величина DрН наиболее близкая к 1). Например, при добавлении 4 мл кислоты DрН = 0,89; при добавлении 5 мл кислоты DрН = 1,07. Тогда 1,07 – 1,00 < 1,00 – 0,89, поэтому для расчета используют DрН = 1,07.
Результаты определения буферной емкости записать в таблицу 13.
Таблица 13
Результаты определения буферной емкости номерного раствора
| Исследуемый раствор | Объем раствора, мл | рН исследуемого раствора | Объем и концентрация прибавленного раствора | рН раствора после прибавления реактива | DрН |
| 20 | 1 2 3 4 .. |
Б = …….
По найденным значениям рН вычислить активность ионов водорода в растворе.
Пример: рН = 2,34
– lg aH+ = 2,34 lg aH+ = – 2,34
lg aH+ = `3,66 aH+ = 4,57×10-3 М.
Результаты записать в таблицу 14.
Таблица 14
Результаты измерения рН и вычисления СН+ растворов
| N п/п | Исследуемый раствор | рН | СН+, М |
| 1 | Дистиллированная вода | ||
| 2 | Почвенная вытяжка водная |
По окончании работы с прибором электроды ополоснуть дистиллированной водой, на электрод сравнения надеть колпачок, стеклянный электрод – погрузить в стаканчик с дистиллированной водой.
4. Потенциометрическое титрование
Потенциометрическое титрование – это метод объемного анализа, в котором индикатором является электродвижущая сила гальванической цепи. Один из электродов этой цепи является индикаторным электродом, величина потенциала которого зависит от концентрации титруемых ионов:
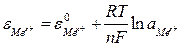
Другой электрод – электрод сравнения (хлорсеребряный, водородный, каломельный) с постоянной величиной потенциала.
В процессе титрования концентрация титруемых ионов уменьшается, а значит, уменьшается и величина e, и величина электродвижущей силы (разности потенциалов) Е. Наиболее резко изменяется Е при переходе через эквивалентную точку титрования.








