Задание 3. Измерение ЭДС медно-хлорсеребряного гальванического элемента и вычисление потенциала медного электрода
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
Для составления этого элемента используют медный электрод, приготовленный в первом разделе работы, и хлорсеребряный электрод сравнения, которым уже пользовались. Измеряют ЭДС так же, как в задании 2, и записывают результат в таблицу 8.
Затем вычисляют потенциал медного электрода, используя уравнение:
Еоп = eCu - eхс, откуда eCu = Еоп + eхс.
Задание 4. Измерение ЭДС медного концентрационного
гальванического элемента
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01 M)|Cu
Для составления медного концентрационного гальванического элемента используют уже приготовленный медный электрод и второй электрод с концентрацией CuSO4 0,01 M, приготовленный так: в проточную электродную ячейку наливают до половины её объема 0,01 М раствор CuSO4, опускают в раствор медную пластинку. Оба электрода опускают в стаканчик с насыщенным раствором KCl. Присоединив зажимы, измеряют Еоп. Проверяют результат у преподавателя, записывают его в таблицу 8. Разбирают медные электроды и ставят в соответствующие концентрациям стаканы для хранения.
Задания 5 и 6. Измерение ЭДС окислительно-восстановительной цепи и вычисление окислительно-восстановительного потенциала
Контрольные растворы для выполнения заданий 5 и 6 получают у преподавателя.
Задание 5.
Схематическая запись элемента:
Pt| 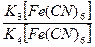 || KClнасыщ, AgCl|Ag
|| KClнасыщ, AgCl|Ag
Выливают из стаканчика насыщенный раствор KCl и ополаскивают его дистиллированной водой. В стаканчик наливают раствор, полученный у преподавателя, и опускают в него хлорсеребряный и ОВ- электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала, используя уравнение:
Еоп = eов – eхс, откуда eов = Еоп + eхс.
Задание 6.
Схематическая запись элемента:
Pt| почва || KClнасыщ, AgCl|Ag
В химический стакан помещают образец почвы, добавляют дистиллированную воду (по заданию преподавателя) до получения однородной пастообразной массы. Опускают в образец хлорсеребряный и ОВ-электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала почвы, используя уравнение:
Еоп = eов – eхс, откуда eов = Еоп + eхс.
Проверив правильность выполненной работы и отметив её у преподавателя, приводят в порядок рабочее место.
ДОМАШНЕЕ ЗАДАНИЕ
1. Вычислить теоретическую величину ЭДС гальванического элемента Даниеля-Якоби теоретически (Етеор):
Нормальный потенциал медного электрода e0Cu = 0,34 В.
Нормальный потенциал цинкового элетрода e0Zn = – 0,76 В.
Поскольку fa,CuSO4 = fa,ZnSO4, теоретическая ЭДС элемента Даниеля-Якоби будет равна
Етеор = e0Cu – e0Zn
Вычисленную теоретическую величину ЭДС записывают в соответствующую графу таблицы 8 и сравнивают её с ЭДС, найденной опытным путем. Эти величины должны отличаться не более чем на 0,05 В.
2. Проверить правильность найденных значений электродных потенциалов медного и цинкового электродов, используя их опытные значения при вычислении ЭДС медно-цинкового гальванического элемента по уравнению
E = eCu – eZn
Сравнивают полученную величину с найденной величиной ЭДС опытным путем в первом задании. Если эти величины отличаются не более чем на 0,01 В, работа выполнена правильно.
3. Проверить правильность измерения ЭДС концентрационной цепи, вычислив теоретически ЭДС медного концентрационного элемента по уравнению
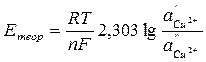
где – 2,303 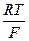 = 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’– активность ионов меди в 1 М растворе сульфата меди; f’– коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
= 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’– активность ионов меди в 1 М растворе сульфата меди; f’– коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
Вычисленную величину Етеор сравнивают с найденной опытным путем Еоп и, если они отличаются не более чем на 0,01 В, записывают результаты в таблицу 8.
4. Рассчитать активность окисленной формы Fе, если известна величина окислительно-восстановительного потенциала (из задания 5 или 6 по указанию преподавателя), активность восстановленной формы Fе равна 0,1, нормальный окислительно-восстановительный потенциал e0ов для данных окислителя и восстановителя равен 0,771 В.
3. БУФЕРНЫЕ СИСТЕМЫ. ИЗУЧЕНИЕ СВОЙСТВ БУФЕРНЫХ И НЕБУФЕРНЫХ СИСТЕМ. ОПРЕДЕЛЕНИЕ БУФЕРНОЙ ЕМКОСТИ РАСТВОРА. ОПРЕДЕЛЕНИЕ рН ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ
Вода – основа жизни на Земле. Она играет исключительно важную роль в биохимических процессах, являясь основной составной частью (от 58 до 97 %) всех клеток и тканей человека, животных, растений и простейших организмов. Вода – это среда, в которой протекают самые разнообразные биохимические процессы.
Вода обладает хорошей растворяющей способностью и вызывает элекролитическую диссоциацию многих растворенных в ней веществ.
Вода является слабым электролитом и диссоциирует на катионы водорода и анионы гидроксила по уравнению:
Н2О Û Н+ + ОН-
Согласно закону действующих масс константа диссоциации воды будет равна:
К = 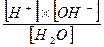
Диссоциация воды очень мала (при 25°С она равна 1.8*10-9), поэтому знаменатель в приведенном уравнении можно считать практически постоянным, и соотношение можно записать следующим образом:
[Н+ ] × [ОН-] =К ×[Н2О] = К w = 10 -14
где К w – ионное произведение воды. Таким образом, произведение концентрации ионов водорода и ионов гидроксила в любом водном растворе есть величина постоянная, называемая ионным произведением воды
Так как компоненты рассматриваемой системы сопряжены, то увеличение концентрации одного иона неизбежно связано с уменьшением концентрации другого. При этом из водного раствора не могут совершенно исчезнуть ни водородные, ни гидроксильные ионы. И при любой их концентрации ионное произведение останется постоянным – 10-14.
Концентрация ионов водорода в растворах представляет важный физико-химический фактор, определение ее имеет большое значение при изучении самых разнообразных физических, химических и биологических процессов.
В природных растворах и биологических жидкостях, которые количественно характеризуются как разбавленные растворы (С £ 0,1 М), активность ионов водорода колеблется примерно в пределах 10-3 £ С £ 10-9М, т.е. она очень мала и для практической работы ее удобно выражать через отрицательный десятичный логарифм активности и обозначать рН:
рН = - lg аН+
Таким образом, водородным показателем – рН – называют величину, численно равную отрицательному десятичному логарифму активности (концентрации) ионов водорода. Логарифмируя ионное произведение воды, получаем:
рН + рОН = 14
В разбавленных водных растворах 0£ рН £14, 0£ рН £7 – в кислых растворах, рН = 7 – в нейтральных и 7 £ рН £14 – в щелочных растворах.
Уравнения для расчета рН в разбавленных растворах различных классов соединений приведены ниже:
Сильные кислоты: рН = - lg aH+.
Сильные основания: pH = 14 – pOH.
Слабые кислоты: pH = ½ (pKк – lgC).
Слабые основания: pH = 14 – 1/2pKо + ½ lgC.
Гидролитически кислые соли: pH = 7 – 1/2pKосн – 1/2lgC.
Гидролитически щелочные соли: pH = 7 + 1/2pKкисл + 1/2lgC.
Буферные растворы: pH = pKa + lg[соль] – lg[кислота].
рH = pKa + lg[основание] - lg[соль].
Буферные системы
Одним из характерных свойств внутренней системы организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, рН крови человека – 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферными системами называются растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) кислотные - слабая кислота и ее соль, образованная этой кислотой с сильным основанием;
б) основные - слабое основание и его соль, образованная этим основанием и сильной кислотой.
На практике часто применяются следующие буферные смеси:
СН3 СООН
СН3СООNa – ацетатный буфер;
Н2СО3
NaHCO3 – бикарбонатный буфер;
NH4OH
NH4Cl – аммиачный буфер
КН2PO4
Na2HPO4 – фосфатный буфер
Pt – COOH – белок-кислота
Pt – COONa – белок-соль – белковый буфер (Pt – протеин-белок).
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранить при добавлении кислот или щелочей. Рассмотрим, что определяет постоянство рН, например, ацетатной буферной смеси
СН3СООН Û Н+ + СН3СОО -
СН3СООNa Þ СН3СОО- + Na+
В ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс, константа диссоциации уксусной кислоты будет:
К = 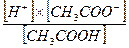 , откуда
, откуда
[H+ ] = К× 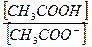
При добавлении к слабодиссоциированной уксусной кислоте (К = 1,86×10-5) ее сильнодиссоциированной соли происходит резкое увеличение концентрации общего аниона (СН3СОО-). В соответствие с законом действия масс это вызывает смещение равновесия влево, т.е. приводит к увеличению недиссоциированных молекул кислоты:
СН3СООН Ü СН3СОО - + Н+
Слабая диссоциация уксусной кислоты еще в большей степени будет подавлена и концентрация недиссоциированных молекул кислоты может быть принята равной общей концентрации кислоты. Так как соль полностью диссоциированна на ионы, то общая концентрация анионов может быть принята за общую концентрацию соли в буферном растворе. Исходя из этого, концентрацию ионов водорода в буферной смеси можно представить в следующем виде:
[H+ ] = Кк× 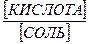
Для основного буфера, каким является, например аммиачный, соответственно будет
[OH -] = Ко× 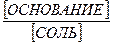
Данные выражения являются основным уравнением буферных растворов. В логарифмической форме эти уравнения принимают вид:
pH = pKк + lg[соль] – lg[кислота]
р H = pKо + lg[основание] - lg[соль]
Таким образом, рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей. Используя основное уравнение буферного раствора, можно вычислить рН любого буферного раствора, зная константу электролитической диссоциации кислоты или основания и концентрации кислоты и соли, а при одинаковых концентрациях их объемные отношения.
Предел, в котором проявляется буферное действие буферной системы характеризуется буферной емкостью. Численное значение буферной емкости (Б) определяется числом моль сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной смеси, чтобы изменить значение рН на 1:
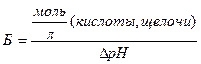
где: DрН – изменение рН при титровании буфера кислотой или щелочью, наиболее близкое к 1 (DрН = рН1 – рН0).
Потенциометрический метод определения рН
В настоящее время наиболее распространен потенциометрический метод определения рН, поскольку он является наиболее точным и быстрым. Метод основан на измерении ЭДС гальванической цепи, составленной из электрода, обладающего водородной функцией, и электрода сравнения. Существует ряд электродов, обладающих водородной функцией (водородный, хингидронный, стеклянный), но в настоящее время в лабораторной практике широко применяется стеклянный электрод с водородной функцией, т.к. он обладает рядом преимуществ. Например, одним из преимуществ стеклянного электрода является то, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
Схематически стеклянный электрод, обладающий водородной функцией, записывается следующим образом:
Ag | AgCl, 0,1н HCl | 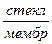 |
| 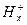 .
.
 Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Ag | AgCl, 0,1н НСl | 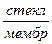 |
| 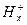
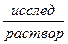 |KClнасыщ, AgCl| Ag.
|KClнасыщ, AgCl| Ag.
Величина потенциала стеклянного электрода (eст) связана с концентрацией Н+- ионов исследуемого раствора уравнением Нернста:
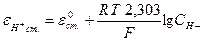 или
или
eН+ст. = e°Н+ст. + 0,0579 lgаН+
где: e0ст – потенциал асимметрии стеклянного электрода, величина переменная (в отличие от металлов) и поэтому требующая корректировки по буферным растворам.
Расчет рН растворов при использовании стеклянно-хлорсеребряной цепи потенциометрическим методом заключается в следующем. ЭДС любой гальванической цепи равна разности электродных потенциалов:
Е = eН+ст. – eхл.
подставим в данное уравнение значение электродного потенциала стеклянного электрода:
Е = e°Н+ст. + 0.0579 lgаН+ – eхл.
решим данное уравнение относительно рН:
-0.0579 lgаН+ = e°Н+ст. – eхл. – Е
Поскольку – lgаН+ = рН, то
рН = e°Н+ст. – eхл. – Е / 0,0579
Биологическое значение
Каждый ион играет особую роль в биологических и химических процессах, однако, водородные ионы занимают особое положение среди всех других ионов. Так, активность ферментов, при помощи которых осуществляется синтез и разложение химических веществ в живой клетке, состоит в непосредственной зависимости от концентрации ионов водорода. Каждый фермент имеет определенную величину рН (таблица 9), оптимальную для его действия, например:
Таблица 9
Оптимальные рН сред для действия некоторых ферментов
| Название ферментов | Оптимум рН |
| Диастаза солоды | 4.9 |
| Сахароза дрожжей | 4.5 |
| Сахароза животных | 6.0-8.0 |
| Лактаза | 7.0 |
| Липаза желудочного сока | 4.0-5.0 |
| Каталаза крови | 7.0 |
| Пепсин при действии на яичный альбумин | 1.2-1.6 |
| Трипсин при действии на казеин | 6.0-6.5 |
Концентрация ионов водорода имеет большое значение в жизнедеятельности микроорганизмов. Установлено, например, что дифтерийный микроб лучше развивается при рН в пределах 7,3–7,6; микроб кишечной палочки при рН = 6–7.
В прямой зависимости от рН находится деятельность почвенных микроорганизмов. Например, активная фиксация азота микробами наблюдается при рН = 7,2.
Отношение высших растений к рН почвы также различно. Так, например, овес, репа, картофель, рожь дают наивысшие урожаи при рН около 5; пшеница, ячмень, свекла, люцерна лучше развиваются при нейтральной реакции почвы или даже слабо щелочной.
По видовому составу луговой растительности можно определить рН почвы – присутствие растения «щучки» (Deschampsia flexuosa) указывает на рН почвы – 3,5–3,9; преобладание осоки (Carex) на рН в пределах 4,5–4,9; преобладание «мать-мачехи» (Tussilfgo farfara) на рН 7,5–7,9 и т.д.
Концентрация ионов водорода имеет большое значение для развития растений. Давно известно, что на кислых почвах многие растения развиваются слабо. Агрономы применяют известкование с целью повышения плодородия почв. Концентрация водородных ионов почв оказывает влияние не только на процессы жизнедеятельности растений, но и на распределение и активность микроорганизмов, населяющих почву, и даже на физико-химическое состояние почвенных коллоидов.
Искусственно изменяя рН среды, например, внесением в почву извести или суперфосфата, мы можем регулировать и изменять бактериальное население почвы, способствовать ее нитрификации и т.д.
рН водной среды является мощным фактором, влияющим на распространение водных организмов. Наиболее благоприятной для жизнедеятельности организмов водной средой является нейтральная или слабощелочная. Реакция воды в пресных водоемах и морях зависит от целого ряда факторов, но все они сводятся к буферному действию. Буферами в море и реках являются угольная кислота, бикарбонаты и карбонаты. Водородный показатель поверхностных слоев морей и океанов поэтому колеблется незначительно, в пределах 8,1-8,3.
В природе есть ряд стоячих водоемов, отличающихся ярко выраженной кислой реакцией. Это – сфагновые болота и озера. Интенсивные процессы гниения, происходящие там, обилие гуминовых веществ, создают среду с рН ниже 5,0, здесь накапливаются минеральные кислоты, например, такая сильная как серная.
Различные водные организмы обладают неодинаковой выносливостью к тем или иным колебаниям рН среды. Например, главная масса пресноводных организмов – инфузории, коловратки, планарии, ракообразные и т.д. выдерживают только нейтрально-щелочные воды в диапозоне рН от 5 до 10. К этой группе организмов следует отнести и все морские организмы.
Функциональная деятельность отдельных органов и тканей высших животных также находится в зависимости от концентрации водородных ионов. Так, у лягушки, при изменении рН крови от 7,5 до 6,5 происходит резкое ослабление сердечной деятельности, а при рН = 6 сердце перестает работать. Изменение рН крови выше 7,3 вызывает сужение сосудов, а ниже – расширение сосудов. При изменении рН в кислую сторону, перистальтика кишечника усиливается. Резко реагирует на изменение рН нервная система. Изменения концентрации ионов водорода могут происходить при различных заболеваниях, причем рН крови может смещаться в кислую – ацидоз или в щелочную среду – алкалоз.
рН крови высших животных и человека поддерживается мощными буферными системами – такими как гем-гемоглобин, оксигемоглобин, белковыми, бикарбонатными. Ниже приводятся показатели концентрации водородных ионов крови, соков и жидкостей организма (таблица 10).
Под влиянием водородных ионов изменяются основные физико-химические свойства веществ и растворов: растворимость, фильтрация, диализ, поверхностное натяжение, вязкость, устойчивость, осмотическое давление, набухание и т.д. Вот почему определение концентрации водородных ионов нашло применение во всех областях химии, биологии, физиологии, бактериологии, медицины, сельского хозяйства и техники.
Таблица 10
| Объект исследования | рН | Объект исследования | рН |
| Кровь животных: бык кролик Собака (сыворотка крови) Лошадь Свинья Баран (сыворотка крови) Коза (сыворотка крови) Овца | 7.36-7.40 7.33-7.35 7.30 7.40-7.60 7.85-7.95 7.82 7.65 7.40-7.58 6.02 | Мышечный сок Слюна лошади Слюна коровы Желудочный сок собаки Желчь Молоко коровы Моча коровы Моча лошади Пот лошади Содержание тонких кишок кур | 7.56 8.10 0.96-080 7.0-8.0 6.2 8.5-8.7 7.4-8.7 7.8-8.9 5.5-6.3 |
Вопросы для самоконтроля
1. Ионное произведение воды. Водородный показатель (рН).
2. Понятие о рН, как показателе реакции среды.
3. Роль концентрации водородных ионов в биологических процессах. Кислотность и щелочность почв.
4. Буферные растворы, их состав.
5. Свойства буферных растворов. Их биологическое значение.
6. Основное уравнение буферных растворов.
7. Буферная емкость, ее определение. Буферность почв и почвенного раствора.
8. Потенциометрический метод определения рН.
Экспериментальная часть








