Задание 1. Измерение ЭДС медно-цинкового гальванического элемента (элемента Даниеля – Якоби)
Схематическая запись элемента:
Сu|CuSO4| KCl | ZnSO4|Zn
E = eCu – eZn
В проточную электродную ячейку медного полуэлемента наливают до половины её объема 1М раствор CuSO4 (fa = 0,041) и опускают в раствор медную пластинку. В проточную электродную ячейку цинкового полуэлемента наливают столько же 1М раствора ZnSO4 (fa = 0,041) и погружают в него цинковую пластинку. Собранные электроды закрепляют в штативе. На столик штатива устанавливают стаканчик с насыщенным раствором KCl и приступают к измерению ЭДС. Для этого необходимо присоединить зажимы к электродам и снять показания с прибора, как описано выше. Найденную опытным путем ЭДС (Еоп) записывают в таблицу 8. Полученные результаты проверяют у преподавателя и приступают к выполнению второго задания. Медный и цинковый электроды оставляют для выполнения последующей работы.
Таблица 8
Результаты определения ЭДС гальванических элементов и потенциалов
отдельных электродов
| Гальванические цепи | Еоп, В | Етеор, В | eоп, В |
| Cu|CuSO4(1 M)| KCl |ZnSO4(1 M)|Zn | |||
| Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn | – | eZn = | |
| Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag | – | eCu = | |
| Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01М)|Cu | |||
Pt| 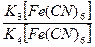 | KCl |KCl,AgCl|Ag | KCl |KCl,AgCl|Ag
| – | eов = | |
| Pt| почва| KCl | KCl, AgCl|Ag | – | eов = |
Задание 2. Измерение электродвижущей силы хлорсеребряно-цинкового гальванического элемента и вычисление потенциала цинкового
электрода
Схематическая запись элемента:
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
Для приготовления этого элемента пользуются имеющимся цинковым электродом. Хлорсеребряный электрод Ag½AgCl, KClнасыщ является электродом сравнения, его потенциал eхс = 0,203 В. Этот электрод погружают в стаканчик с насыщенным раствором KCl, отсоединяют медный электрод и сохраняют его для 3-го и 4-го заданий. Присоединив зажимы к цинковому электроду и хлорсеребряному электроду, измеряют ЭДС хлорсеребряно-цинкового гальванического элемента и записывают в таблицу 8 значение Еоп в вольтах.
Вычисляют потенциал цинкового электрода, используя уравнение:
Еоп = eхс - eZn, откуда eZn = eхс - Еоп
Проверив правильность полученных результатов у преподавателя, разбирают цинковый электрод. Вынимают из электродной ячейки цинковую пластинку, зачищают её и тщательно вытирают фильтровальной бумагой. Из ячейки выливают раствор ZnSO4 и ополаскивают её дистиллированной водой. Собрав полуэлемент, помещают его в стакан для хранения цинковых полуэлементов.








