Таким образом, элктродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева).
Водородный электрод может быть использован и как индикаторный электрод. Индикаторным (может быть и первого, и второго рода), называется электрод, который содержит исследуемый раствор и по величине потенциала которого, можно рассчитать активность (концентрацию) ионов в растворе, например, медный Cu|CuSO4 , цинковый Zn|ZnSO4 , железный Fe|FeCl3 и другие.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли и погруженного в раствор какой-либо легко растворимой соли с тем же анионом. Эти электроды обратимы относительно аниона и формула их электродного потенциала записывается так:
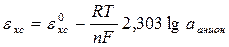
Электродами второго рода являются такие электроды как:
· Хлорсеребряный – Ag|AgCl, KCl(насыщ. р-р); ε = 0.203 В.
· Каломельный – Hg|Hg2Cl2, KCl(насыщ. р-р); ε = 0.25 В.
Электроды второго рода отличаются хорошей воспроизводимостью, постоянством потенциала и легкостью приготовления, поэтому их широко применяют как электроды сравнения. К электродам сравнения относятся также:
водородный электрод – Pt,H2 | 2H+, eH+ = 0 В при аН+ = 1моль/литр и
каломельный – Hg|Hg2Cl2, КClнасыщ , eк = 0,25 В.
Однако электроды второго рода могут применяться и в качестве индикаторных электродов. В таком случае их потенциал будет изменяться относительно концентрации измеряемого аниона.
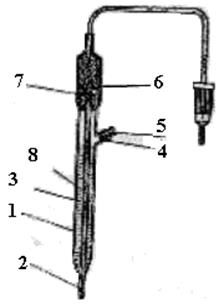
Рис.4. Хлорсеребряный электрод.
1 - корпус; 2 - асбестовая нить; 3 - раствор KCl; 4 - отверстия для заливки раствора хлористого калия; 5 - резиновая пробка; 6 - серебряная проволока;
7 - хлористое серебро; 8 - асбестовый фитиль.
Стандартным (нормальным) электродным потенциалом называется потенциал, возникающий на электроде в нормальных условиях (Р = 101,3 кПа = 1атм; Т = 298ºК) при активности ионов в электродном растворе, равной 1 г-экв/л. Величины нормальных (стандартных) электродных потенциалов находятся экспериментальным путем относительно водородного электрода, причем нормальный потенциал водородного электрода условно принимается равным нулю. Таблица нормальных потенциалов называется рядом напряжений. В таблице 6 приведены стандартные электродные потенциалы некоторых электродов.
Таблица 6
Нормальные потенциалы некоторых электродов при 298°K (ряд напряжений)
| Электрод | Электродный процесс | e, В |
| Zn|Zn2+ | Zn Û Zn2++ 2e- | – 0,76 |
| Fe|Fe2+ | Fe Û Fe2+ + 2e- | – 0,44 |
| Cd|Cd2+ | Cd Û Cd2+ + 2e- | – 0,40 |
| Fe|Fe3+ | Fe Û Fe3+ + 3e- | – 0,04 |
| Pt(H2)|H+ | ½ H2 Û H+ + e- | 0,00 |
| Cu|Cu2+ | Cu Û Cu2+ + 2e- | + 0,34 |
| Hg|Hg2+ | Hg Û Hg2+ + 2e- | + 0,80 |
Окислительно-восстановительный электрод состоит из пластинки индифферентного металла (платина, золото и пр.), находящегося в контакте с раствором, содержащий ионы одного и того же элемента, но разной валентности, или с веществами различной степени окисления. Гальванические цепи, в состав которых входят окислительно-восстановительный электрод и электрод с известным потенциалом (электрод сравнения), называются окислительно-восстановительными. Схематически такие цепи записываются:
Pt| Mx+,My+ || электрод с известным потенциалом (электрод сравнения)
Например: Pt|Fe2+,Fe3+ || KClнасыщ, AgCl|Ag
Величина окислительно-восстановительного потенциала рассчитывается по уравнению Нернста - Петерса:
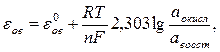
где 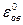 – нормальный (стандартный) окислительно-восстановительный потенциал, аокисл – активность окисленной формы, авосст – активность восстановленной формы.
– нормальный (стандартный) окислительно-восстановительный потенциал, аокисл – активность окисленной формы, авосст – активность восстановленной формы.
Стандартным (нормальным) окислительно-восстановительным потенциалом называется потенциал, возникающий в стандартных условиях на индифферентном электроде при соотношении 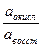 , равном 1. В таблице 7 приведены некоторые стандартные окислительно-восстановительные потенциалы.
, равном 1. В таблице 7 приведены некоторые стандартные окислительно-восстановительные потенциалы.
Таблица 7
Стандартные окислительно-восстановительные потенциалы в водных растворах
| Электрод | Электродный процесс | e, В |
| Cr2+|Cr3+|Pt | Cr3+ + e- Û Cr2+ | – 0,41 |
| Sn2+|Sn4+|Pt | Sn4+ + 2e- Û Sn2+ | +0,15 |
| MnO4-,MnO2-|Pt | MnO4- + e- Û MnO42- | +0,564 |
| Fe2+|Fe3+|Pt | Fe3+ + e- Û Fe2+ | +0,771 |
| Mn2+,Mn3+|Pt | Mn3+ + e- Û Mn2+ | +1,51 |
| Pb4+|Pb2+|Pt | Pb4+ + 2e- Û Pb2+ | +1,70 |
| Co2+,Co3+|Pt | Co3+ + e- Û Co2+ | +1,82 |
Почвы представляют собой окислительно-восстановительные системы, т.к. они содержат ионы различной валентности, например, Fe2+/Fe3+ , Mn2+/Mn3+, N+5/N+3, а также органические вещества различной степени окисления.
Гальванические цепи из одинаковых электродов, но с различной активностью ионов называются концентрационными и записываются так:
M| 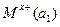 |электролитический|
|электролитический| 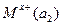 |M
|M
e1 проводник e2
при этом а1 > а2.. ЭДС таких элементов вомногом определяется диффузионным потенциалом, возникающим в растворе из-зи разности концентраций электролита.
Биологическое значение
Потенциалы, возникающие в живых организмах – диффузионные, мембранные, межфазовые, окислительно-восстановительные – являются по своей химической природе аналогами электродных потенциалов. В тканях организма, даже внутри одной клетки, имеются мембранные и межфазовые потенциалы, обусловленные морфологической и химической неоднородностью внутреннего содержания клеток. При работе сердца, сокращениях мышц и т.д. возникают так называемые токи действия, являющиеся результатом различной проницаемости клеточных мембран для различных ионов. Вследствие этого концентрация ионов по обеим сторонам мембраны неодинакова (возникает мембранный потенциал). В момент возбуждения (сокращения мышц и т.д.) избирательность проницаемости мембран утрачивается и сквозь них устремляется поток ионов – возникает электрический ток.
Существует теория возникновения биоэлектрических потенциалов. Согласно ей, в покое электролиты внутри клетки избирательно связываются белками, в результате возникает межфазовая разность потенциалов между протоплазмой и водным раствором электролита (потенциал покоя). При возбуждении или повреждении клетки фазовые свойства белков протоплазмы изменяются, распределение ионов становится другим и соответственно меняется потенциал (возникает потенциал действия или повреждения). Величина потенциала покоя для нервных волокон у амфибий составляет 70 мВ, для мышечных волокон сердца теплокровных животных – 95 мВ.
Окислительно-восстановительные (red/ox - редокс) потенциалы имеют большое значение в физиологии растений и животных. К числу редокс-систем животных относятся такие системы в крови и тканях как: гем-гематин и цитохромы, в которых содержится двух- и трехвалентное железо; аскорбиновая кислота (витамин С), находящаяся в окисленной и восстановленной формах; система глютатиона, цистин-цистеин и др.
Важнейший процесс биологического окисления, а именно, перенос электронов и протонов с окисляемого субстрата на кислород, осуществляемый в тканях при помощи строго определенного ряда промежуточных ферментов-переносчиков, также представляет собой цепь окислительно-восстановительных процессов, каждое звено этой цепи соответствует той или иной редокс-системе, характеризующейся определенным редокс-потенциалом.
Окислительно-восстановительные реакции играют важную роль в процессах почвообразования, на что впервые указал В.Р. Вильямс. Нормальный рост и развитие растений возможны только при определенном окислительно-восстановительном состоянии почвы.
Большая величина редокс-потенциала почвы указывает на то, что в почвенном растворе содержатся в значительном количестве вещества, находящиеся в окисленной форме. В качестве окислителей в почвенном растворе выступает главным образом кислород и некоторые ионы, способные присоединять электроны – анион азотной кислоты NO3- трехвалентные катионы железа, марганца и др.
Малое значение редокс-потенциала почвы обусловлено наличием в ней значительных количеств восстановителей, к которым относятся, прежде всего, легко окисляющиеся органические вещества, а также двухвалентные катионы железа и марганца.
Преобладание в почве окислителей приводит к тому, что ионы Fe ++ и Mn++ окисляются в трехвалентные ионы, которые выпадают из почвенного раствора в виде нерастворимых соединений. В результате этого нарушается нормальное питание растений, т.к. они не получают необходимого количества железа и марганца.
При избытке в почве восстановителей железо и марганец находятся в растворе в виде двухвалентных ионов в таких концентрация, при которых они оказывают вредное действие на растительные организмы.
Как показали многочисленные исследования, для нормального развития растений необходимо, чтобы редокс-потенциал почвы находился в пределах 0,2-0,7 В.
Вопросы для самоконтроля
1. Как возникает скачок потенциала на границе раздела металл-раствор.
2. Напишите уравнение электродного потенциала (Нернста).
3. Что такое электрод? Приведите примеры.
4. Электроды первого и второго рода, их назначение.
5. Электроды сравнения. Примеры.
6. Окислительно-восстановительные электроды и цепи. Уравнение Нернста-Петерса.
7. Гальванические элементы (цепи). Концентрационные цепи. Примеры.
8. Диффузионный потенциал и меры его устранения.
Экспериментальная часть
Работу проводят на ионометре (потенциометре, рис.5). Перед началом работы прибор включают в сеть и дают ему прогреться в течение 5 минут. Работают при нажатых клавишах «±» и «mV» на левом клавишном переключателе.
Прибор имеет две шкалы, которые переключаются клавишами правого ряда. Нижняя шкала включается клавишей «–1 – 19». Она имеет деления от –1 до 19; эта шкала грубая и служит для выбора одного из более узких диапазонов измерения («–1 – 4», «4 – 9», «9 – 14», «14 – 19»). Точное измерение проводят по верхней шкале, предварительно нажав кнопку выбранного диапазона. Например, выбран диапазон «–1 – 4», следовательно, первое большое деление на верхней шкале соответствует “-1”, а затем идут соответственно 0; 1; 2; 3; 4. Если выбран диапазон измерений «9 – 14», нажимаем соответствующую кнопку диапазона, при этом первое деление соответствует «9», а последующие 10, 11, 12, 13, 14.
Шкала прибора откалибрована в милливольтах (mV), следовательно, чтобы снятое с прибора показание выразить в вольтах, необходимо
рX×100/1000 = pX/10,
где pX - показание прибора.

Рис.5. Иономер универсальный








