Задание 1. Определение постоянной калориметра
Теплота химической реакции, принимаемая или отдаваемая водяным калориметром, будет изменять температуру воды, находящейся в стакане Б, и температуру других частей прибора, находящихся в воде. В этом случае количество теплоты будет равно
Q = (M1C1 + M2C2) × Dt
где M1 – масса воды, С1 – теплоемкость воды, М2 и С2 – усредненные значения масс и теплоемкости для стекла стакана, мешалки и других частей калориметра.
При наполнении стакана Б и неизменности частей, погружаемых в воду, М1С1 + М2C2 = const = Z, которую называют постоянной калориметра.
Таким образом,
Q = Z×Dt
из чего следует, что при Dt = 1°, Q = Z. Иначе говоря, постоянная калориметра – это количество теплоты, необходимое для изменения температуры всех частей калориметра на 1°. Следовательно, до проведения эксперимента по определению теплового эффекта химической реакции Qp следует прокалибровать прибор (калориметр), т.е. определить постоянную калориметра Z. Этого можно достичь, вводя или отнимая известное количество теплоты (Qp) в данном калориметре с одновременным точным измерением изменения температуры. Тогда постоянную калориметра можно определить по формуле
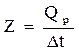
Существует несколько способов определения постоянной калориметра. В данной работе постоянная Z устанавливается по теплоте растворения KCl.
В стакан Б калориметра наливают 400 мл дистиллированной воды. Опускают крышку калориметра так, чтобы она плотно соприкасалась с верхней частью сосуда А (рис.1). Нижняя часть термометра и мешалки при этом должны находиться на расстоянии 1–2 см от дна стакана Б. Включают мотор для вращения мешалки и снимают температуру с точностью до 0,01°, пользуясь при этом лупой. Начинается предварительный период эксперимента, в течение которого записывают показания термометра через каждую минуту. Предварительный период длится 10 минут, время фиксируется по секундомеру.
На 11-ой минуте в отверстие крышки калориметра вставляется воронка В, через которую в воду всыпается 7,2 г КСl. В процессе растворения КСl температура начинает резко изменяться. Начинается главный период эксперимента, в течение которого температура фиксируется через каждые полминуты.
После того как температура, достигнув минимума, начнет равномерно повышаться, начинается заключительный период эксперимента, который продолжается 10 минут. В заключительном периоде температура фиксируется через каждую минуту. Данные заносят в таблицу 3.
Полученные данные наносят на миллиметровую бумагу, откладывая по оси абсцисс время в минутах, а по оси ординат – температуру. Через точки предварительного и заключительного периодов проводят прямые линии. Из середины главного периода (точка С, рис.2) проводят перпендикуляр до пересечения с продолжением прямых предварительного и заключительного периодов (точки М и N рис. 2). Из точек пересечения опускают перпендикуляры на ось ординат. Отсекаемый отрезок на оси ординат (t1 – t2) равен Dt.
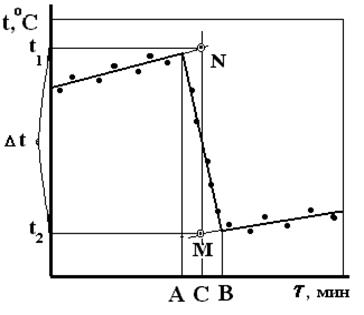
Рис. 2. Графическое определение Dt для вычисления постоянной калориметра.
Тепловой Qp, как ранее было сказано, вычисляется на 1 моль прореагировавшего вещества, но в данном случае в калориметре находилось g г вещества, а потому
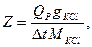
где g – навеска КСl (в граммах), М – молекулярная масса для КСl, Qp в случае растворения KCl в воде составляет 4440 кал/моль.








