Вопросы для самоконтроля
1. Что изучает термодинамика?
2. Что такое тепловой эффект химической реакции?
3. В каких единицах измеряются тепловые эффекты?
4. Как формулируется первое начало термодинамики? Его математическая запись.
5. Что представляет собой энтальпия, в чем её физический смысл?
6. Тепловые эффекты при постоянном объеме и постоянном давлении?
7. Как формулируется второе начало термодинамики? Его математическая запись.
8. Изобарно-изотермический потенциал. Свободная энергия Гиббса и Гельмгольца.
9. Что изучает термохимия?
10. Сформулируйте закон Гесса и следствия из закона Гесса. Какова его математическая запись закона Гесса.
Экспериментальная часть
При выполнении работы необходимо обращать внимание на знаки «+» или «–», которые характеризуют тепловые эффекты реакций. В термодинамике приняты следующие правила при обозначении обмена энергией между системой и внешней средой. В какой бы форме не происходил обмен энергией количество энергии, полученное системой, обозначается знаком «+». Количество энергии, отданное системой во внешнюю среду – знаком «–». В термохимии принято обратное обозначение. Таким образом, в термодинамике и термохимии пользуются обратной системой знаков. Если система отдает энергию во внешнюю среду, в термохимии это обозначается плюсом (экзоэффект или экзотермические реакции), а в термодинамике минусом. Если система приобретает энергию из внешней среды, в термохимии будет знак минус (эндоэффект или эндотермические реакции), а в термодинамике – знак плюс.
Приборы, при помощи которых определяют тепловые эффекты химических реакций, называются калориметрами. В данной работе для экспериментального определения теплового эффекта химической реакции используется калориметр с воздушной изотермической оболочкой. Подобные приборы обеспечивают точность определения тепловых эффектов до ± 2 % при изменении температуры системы на 0,5° и больше. Поскольку в калориметрах такой конструкции реакция происходит при постоянном (атмосферном) давлении, то измеряемый тепловой эффект будет представлять собой Qp.
Калориметр состоит из толстостенного сосуда А объемом 2–3 литра, в который на корковых пробках устанавливается стеклянный или пластмассовый стакан Б емкостью 500 -600 мл. Сосуд А закрывается стеклянной или пластмассовой крышкой с тремя отверстиями: для мешалки М, для термометра Т и для воронки В, через которую вносится реагент (рис.1).
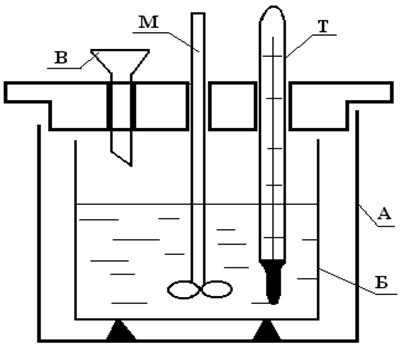
Рис.1. Калориметр.
А – внешний сосуд, Б – внутренний сосуд, в который заливается реагент,
Т – термометр, М – мешалка, В – воронка, через которую всыпается
второй реагент.








