Таким образом, стандартная энтальпия химической реакции равна разности сумм стандартных энтальпий образования всех продуктов и всех реагентов. Так записывается математически закон Гесса.
Если из данных исходных реагентов можно различными путями получить одни и те же конечные продукты, то, независимо от путей получения продуктов, т.е. от вида и количества промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же. Иначе говоря, тепловой эффект химической реакции не зависит от пути перехода "реагенты – продукты", т.е. от промежуточных реакций, а зависит только от вида и состояния продуктов и реагентов. Это положение было постулировано русским ученым Г.И. Гессом в 1840 году и известно как закон Гесса, являющийся основным законом термохимии.
Следствия из закона Гесса:
1. Закон Лавуазье-Лапласа. Тепловой эффект реакции разложения точно равен и противоположен по знаку тепловому эффекту реакции соединения.
Пример:
Са + 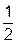 О2 = СаО + 634,71 кДж
О2 = СаО + 634,71 кДж
СаО = Са + 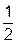 О2 – 634,71 кДж
О2 – 634,71 кДж
Qразл + (– Qсоед ) = 0.
2. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое.
Пример:
1) С + О2 = СО2 + 409,20 кДж
2) СО + ½ О2 = СО2 + 284,93 кДж
Вычитая из уравнения (1) уравнение (2), можно вычислить тепловой эффект реакции сжигания углерода до окиси углерода:
С + ½ О2 = СО + 124,27 кДж
Таким образом, можно определять тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто и до конца.
3. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое.
Пример:
Суголь + О2 = СО2 + 409,20 кДж
Сграфит + О2 = СО2 + 393,51 кДж
Таким образом, можно рассчитать тепловой эффект перехода от угля к графиту, который будет равен 409,00 – 393,51 = 15,69 кДж/моль.
Энтропия, в отличие от многих других термодинамических функций, имеет точку отсчета. Эта точка отсчета задается 3-им законом термодинамики, который еще называют постулатом Планка: при абсолютном нуле (T = 00К) все идеальные кристаллы имеют одинаковую энтропию, равную нулю.
При стремлении температуры к абсолютному нулю не только энтропия стремится к нулю, но и ее производные по всем термодинамическим параметрам. Это означает, что вблизи абсолютного нуля все термодинамические процессы протекают без изменения энтропии.
Биологическое значение
Живые организмы не являются исключением из законов природы. Любой организм, растительный и животный, находится в постоянном обмене энергией и веществом с окружающей средой. Он поглощает разнообразные вещества в виде пищи, ассимилирует и трансформирует их в составные части своего тела, разрушает их в процессе диссимиляции и удаляет их в качестве отработанных продуктов во внешнюю среду. Многочисленными экспериментами была установлена подчиненность этих процессов закону сохранения материи и энергии.
Приведем для иллюстрации опыты Биддера и Шмидта над взрослой кошкой, находящейся в состоянии пищевого равновесия (Таблица 1, данные приведены в г/1кг веса животного в сутки).
Таблица 1
| Поступления | Общий вес | Н2О | С | Н | N | О | S | соли |
| мясо | 44.118 | 32.957 | 6.109 | 0.851 | 1.390 | 2.184 | 0.086 | 0.441 |
| вода | 27.207 | 27.207 | - | - | - | - | - | - |
| кислород | 18.632 | - | - | - | - | 18.632 | - | - |
| ИТОГО | 89.957 | 60.164 | 6.209 | 0.851 | 1.390 | 20.816 | 0.086 | 0.441 |
| Выделения | ||||||||
| моча | 53.350 | 49.817 | 0.592 | 0.197 | 1.380 | 0.858 | 0.042 | 0.409 |
| кал | 0.910 | 0.718 | 0.075 | 0.010 | 0.002 | 0.031 | 0.044 | 0.032 |
| Н2СО3 | 20.322 | - | 5.542 | - | - | 14.870 | - | - |
| вода (через легкие и кожу) | 15.355 | 9.569 | - | 0.644 | - | 5.152 | - | - |
| потери азота | 0.008 | - | - | - | 0.008 | - | - | - |
| ИТОГО | 89.957 | 60.164 | 6.209 | 0.851 | 1.390 | 20.816 | 0.086 | 0.441 |
Сравнение потребляемых и выделяемых веществ свидетельствует о глубоких превращениях пищи в организме. Эти превращения связаны с производством энергии, возникающей в процессе распада пищевых веществ и необходимой организму для производства работы (мышечное сокращение), для синтеза и ассимиляции, для выработки тепла.
Живые организмы также подчинены законам термохимии, в частности закону Гесса. Этот закон имеет огромное значение для физиологии и биохимии. Действительно, окисление пищевых продуктов в организме происходит через серию сложных реакций, однако, количество теплоты, выделяемое при этом, сравнимо с количеством теплоты, которое можно получить при непосредственном сжигании этих веществ в колориметрической бомбе (прибор для определения теплоты сгорания).
Закон Гесса дает основание использовать теплоты сгорания пищевых веществ для суждения об энергии окисления в организме. Экспериментальными исследованиями многих ученых были определены теплоты сгорания пищевых веществ в калориметрической бомбе (таблица 2), и они оказались тождественны с калорийной ценностью при окислении в организме.
Белки в организме окисляются не полностью. В качестве продукта неполного окисления белков выделяется мочевина, чем и обусловливается расхождение теплоты сгорания в организме и калориметре.
Таким образом, приведенные данные неопровержимо свидетельствуют о том, что энергетические процессы в организме подчиняются закону сохранения энергии, как и любые химические реакции вне организма, идут по законам термохимии.
Таблица 2
| вещество | теплота сгорания в организме (ккал) | теплота сгорания в калориметре (ккал) |
| углеводы | 4,1 | 4,1 |
| жиры | 9,3 | 9,3 |
| белки | 4,1 | 5,7 |








