Каждая материальная система сама по себе стремится к состоянию термодинамического равновесия.
Существует другая формулировка 2-го закона термодинамики: Энтропия вселенной всегда возрастает.
Таким образом, второй закон термодинамики ограничивает превращение энергии в материальной системе. Клаузиус, подобно Ломоносову, так формулирует второе начало термодинамики: теплота не может сама собой перейти от тела менее нагретому к телу более нагретому.
В современной трактовке второе начало термодинамики звучит таким образом:
Энергия самопроизвольно перемещается от системы с более высоким потенциалом к системе с более низким потенциалом энергии того же вида, до тех пор, пока не наступит термодинамическое равновесие.
Изменение энтропии равно тепловому эффекту процесса, деленному на абсолютную температуру, при которой он происходит, и измеряется в
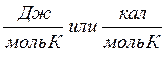 .
.
Для обратимых изотермических реакций изменение энтропии равно
∆ S = 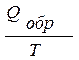
где Qобр – часть общего количества энергии, выделенной системой в виде тепла.
Таким образом, если DS = 0, то процесс обратимый. Данное уравнение является математическим выражением второго начала термодинамики для обратимых процессов, происходящих в изолированной системе.
Для необратимых химических процессов, протекающих в изолированной системе, второе начало термодинамики имеет следующий вид:
∆ S > 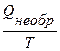
Таким образом, если в изолированной системе протекает самопроизвольный (необратимый) процесс, то DS > 0.
Процессы, для которых
∆ S < 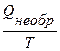
самопроизвольно осуществляться в изолированной системе при постоянной температуре не будут. Энтропия как критерий направленности самопроизвольных (необратимых) процессов может быть использована только для характеристики процессов в изолированных системах.
Физический смысл энтропии сводится к характеристике меры хаоса (беспорядка) в системе. Чем больше изменение энтропии в системе, тем меньше полезной работы может совершить данная система.
Изолированная система является идеальным случаем, т.е. такая система не взаимодействует с окружающей средой ни путем обмена энергией, ни путем обмена веществом. Реальные термодинамические системы являются либо закрытыми (могут обмениваться с окружающей средой энергией), либо открытыми (могут обмениваться с окружающей средой и энергией, и веществом). Для указания на направленность самопроизвольного процесса в таких системах используется другая термодинамическая функция – свободная энергия Гиббса ( G).
Термодинамическая функция G = H – T×S называется свободной энергией Гиббса, или изобарно-изотермическим потенциалом, или полезной работой. Используется для характеристики системы с точки зрения совершения полезной работы, а также для указания на направленность самопроизвольных процессов, идущих при Р = const и Т = const. В случае самопроизвольных (необратимых) процессов DG < 0, Если в результате процесса DG увеличивается (DG > 0), то такой процесс идет самопроизвольно в обратном направлении. В обратимых процессах в момент достижения равновесия DG = 0.
Термохимия - это раздел термодинамики, в котором изучаются химические реакции с точки зрения их тепловых эффектов. Рассмотрим закрытую термодинамическую систему, в которой происходит химическая реакция
аА + вВ = сС + dD
В начальном состоянии такая система имеет запас внутренней энергии U1, (а) молей реагента А и (в) молей реагента В. В конечном состоянии, т.е. после прохождения реакции, система будет иметь запас внутренней энергии U2, (с) молей продукта С и (d) молей продукте D. Тепловым эффектом реакции будет называться количество энергии, которая выделяется либо поглощается в форме тепла при взаимодействии реагентов А и В с образованием продуктов С и D с учетом стехиометрических коэффициентов реакции. В зависимости от условий, в которых будет протекать химическая реакция (либо V = const, либо Р = сonst), тепловым эффектом реакции будет либо Qv = DU, либо Qp = DН.
Чтобы сравнить между собой тепловые эффекты разных реакций, необходимо указать точные условия, при которых они протекают. В термодинамике и термохимии за стандартные условия приняты Р = 1 атм и Т = 298ºК, при этом вещество в этих условиях должно находиться в наиболее устойчивом агрегатном состоянии. Для реакций, проходящих в стандартных условиях, изменение энтальпии обозначается символом DН0298K.
Для реакций, протекающих в газовой фазе, было установлено соотношение между Qp и Qn:
Qp = Qv + Dn×RT
Это соотношение устанавливает связь между теплотой реакции при постоянном давлении (Qp или DН) и теплотой реакции при постоянном объеме (Qv или DU), является следствием из закона Джоуля. В данном уравнении Dn - разность между числом молей образовавшихся газообразных продуктов и числом молей газообразных реагентов
Dn = nгазовых продуктов – nгазовых реагентов
Для реакций в конденсированных фазах (твердых и жидких), объем которых в ходе реакции практически не изменяется, т.е. Dn = 0, DН практически не отличается от DU. В этих случаях справедливы равенства
Qp = Qv и DH = DU
Реакции, в результате которых вещество получается из химических элементов (простых веществ), называются реакциями образования. Изменение энтальпии в ходе таких реакций называется энтальпией образования данного соединения. Не все реакции образования можно реализовать практически. Например, реакция
2С + 3H2 + 1/2O2 = C2H5OH
теоретически является реакцией образования, но практически самопроизвольно не идет. Реакция
С + О2 = СО2
тоже является реакцией образования, но в отличие от первой, она достаточно легко может быть проведена практически.
Стандартной энтальпией образования химического соединения называется изменение энтальпии в ходе реакции образования 1 моль данного соединения из элементов в стандартных условиях и обозначается символом 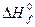 .
.
В ходе реакций образования тепловой эффект представляет собой именно стандартную энтальпию образования соединений, потому что стандартная энтальпия образования самих химических элементов (или простых веществ) принята равной нулю ( 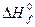 (элементов) = 0).
(элементов) = 0).
Знание стандартных энтальпий образования позволяет рассчитать тепловой эффект любой химической реакции (Qp = DH) не прибегая к экспериментальным измерениям. Из химических элементов можно: 1) получить непосредственно продукты. Соответствующее изменение энтальпии этой реакции будет равно 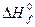 (продуктов). Из элементов можно: 2) получить реагенты. Эта реакция сопровождается изменением энтальпии
(продуктов). Из элементов можно: 2) получить реагенты. Эта реакция сопровождается изменением энтальпии 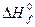 (реагентов). Наконец, 3) из реагентов можно получить продукты. Изменение энтальпии в ходе этой реакции будет равно DН. Если эти три процесса проходили в стандартных условиях, то термодинамический баланс этих реакций будет равен:
(реагентов). Наконец, 3) из реагентов можно получить продукты. Изменение энтальпии в ходе этой реакции будет равно DН. Если эти три процесса проходили в стандартных условиях, то термодинамический баланс этих реакций будет равен:
DН0298 K = å 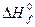 298К (продукты) – å
298К (продукты) – å 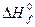 298К (реагенты)
298К (реагенты)








