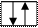
Атомы щелочных металлов содержат на внешнем энергетическом уровне только 1 электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильными восстановителями.
Тема урока: Обзор металлов .
Цель урока: углубить знания о химических свойствах металлов, развивать умения составлять уравнения химических реакций.
Эпиграфом нашего урока можно взять слова Михаила Васильевича Ломоносова: «Металлы – светлое тело, которое ковать можно».
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
Именно ковкость и пластичность металлов были важнейшими свойствами, благодаря которым металлы начали активно использоваться человеком. Первые сведения использования металлов в хозяйственной деятельности людей относятся к 4-3 тыс. до н.э. Это время называют медным веком. Затем бронза заменила чистую медь и именно из этого сплава начали изготавливать орудия труда и оружие.
Когда человек научился получать температуру более 1500 °С наступила эпоха изделий из железа и его сплавов – чугуна и стали. Это время стали называть железнымвеком, начало которого датируют с середины 1 тыс. до н.э. условно можно сказать, что железный век продолжается и по сей день. Ведь примерно 9/10 из всех используемых металлов и сплавов – это сплавы на основе железа. Сегодня мы разбираем свойства металлов главных подгрупп.
«Общая характеристика металлов».
| Металл-элемент | Металл-вещество |
| 1.Кристаллическая решетка - металлическая |
| 2.Вид химической связи - металлическая |
| 3. Металлы являются восстановителями. Ме0 – nе = Меn+. |
Самые мягкие – щелочные металлы,
Самый твердый – хром,
Самый легкий – литий (плотность 0,53 г/см),
Самый тяжелый осмий (плотность 22,5 г/см),
Самый легкоплавкий – ртуть (температура плавления –( -38,9С),
Самый тугоплавкий – вольфрам (3420 С),
Магнитными свойствами обладают железо, никель, кобальт,
Вытягиваются в проволоку и листы – золото, медь, алюминий,
Хрупкие – висмут и марганец,
Самые блестящие – серебро, алюминий, палладий,
Наиболее электропроводные – серебро, медь, золото, алюминий.
Драгоценные металлы- золото, серебро, платина, рутений, родий, осмий, иридий.
Радиоактивные металлы – уран, торий, полоний, актиний, франций, радий.
1.Классификация металлов.
Металлы 1 главной подгруппы называются щелочными –образуют щелочи, 2 группы – щелочноземельными, из 3 группы изучаем свойства одного из широко применяемых в технике металлов – алюминия.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только 1 электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильными восстановителями.
Строение атома лития и натрия:

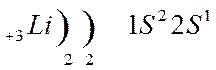

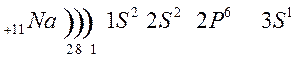
Вот, что говорится об элементах 1 группы главной подгруппы ПСХЭ:
Следующие за щелочными металлами элементы составляют главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью. Са, Sr, Ba, Ra – щелочноземельные металлы.

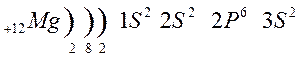
К металлам относятся и элементы главной подгруппы III группы, исключая бор.










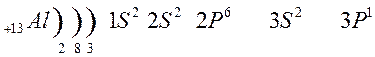
Из элементов главных подгрупп следующих групп к металлам относят:
в IV группе – германий, олово, свинец;
в V группе – сурьма и висмут;
в VI группе – полоний.
Элементы побочных подгрупп – все металлы.
2.Химические свойства металлов.
Зная строение металлов, можно предвидеть их общие химические свойства.
В атомах металлов на внешней электронной оболочке находятся электроны, которые легко отрываются от атомов.
Наиболее общим химическим свойством металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются сильными восстановителями.
2.1. Взаимодействие с простыми веществами: кислородом, галогенами, серой, азотом, водородом.
Реакции с кислородом.
4 Nа + O2 → 2 Nа2O; (побочный продукт)
Взаимодействие с галогенами.
2К + Cl2 →2 КCl;
Взаимодействие с серой.
2K + S → K2 S;
Са + S → СаS;
Взаимодействие с азотом.
6К + N2 → 2K3 N;
Взаимодействие с водородом (щелочные металлы).
2К + Н2 → 2КН
Обратите внимание, что в этих реакциях атомы металлов отдают электроны, т.е. являются восстановителями, а неметаллы принимают электроны, т.е. являются окислителями.
Вывод: Запомните, металлы реагируют с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями.
Давайте теперь рассмотрим с вами взаимодействие металлов со сложными веществами.
2.2. Взаимодействие со сложными веществами.
2.2.1. Взаимодействие металлов с водой.
При каких условиях металлы вступают в реакцию с водой? (При обычной температуре и при нагревании).
Что образуется при взаимодействии воды с активными металлами при обычной температуре? (Образуется гидроксид и выделяется водород).
Обсуждаем, какой металл реагирует более активно с водой? Почему? С чем это связано? (Положение в ПСХЭ, чем больше радиус, тем активнее металл).
2Na + H2O → 2NaOH + H2 ↑.
Ca + 2H2O → Ca(OH)2 + H2 ↑.
Как вы думаете, почему натрий более активно взаимодействует с водой, чем кальций? (Натрий более активный металл, чем кальций. Он легко отдает свои валентные электроны, является самым сильным восстановителем).
При взаимодействии воды с менее активными металлами образуются оксиды металлов и выделяется водород. Это металлы, стоящие в ряду напряжений после алюминия. Составляем уравнение реакции взаимодействия цинка с водой.
Zn + H2O → ZnO + H2 ↑;
Скажите пожалуйста, все ли металлы взаимодействуют с водой? (Нет).
Совершенно верно. А почему? (см. электрохимический ряд напряжения).
Скажите, а будет ли золото взаимодействовать с водой? (Нет).
Почему? (В ЭХ ряду после водорода) .Медь, ртуть, серебро, платина, золото с водой не реагируют!
Au + H2O → реакция не идет
Запомните! Металлы, стоящие в электрохимическом ряду напряжений до алюминия (включительно) образуют с водой гидроксиды, от алюминия до свинца – оксиды. Остальные с водой не реагируют.
2.2.2. Взаимодействие металлов с растворами кислот.
Мg + 2HCl → Мg Cl2 + H2 ↑;
Запомните!Металлы стоящие в электрохимическом ряду напряжений до водорода могут вытеснять водород из растворов кислот. Металлы стоящие в электрохимическом ряду напряжений после водорода не могут вытеснять водород из растворов кислот.
Cu + H2SO4 → не реагирует.
Какой же вывод можно сделать из этого? С помощью преподавателя находят правильные ответы на поставленные вопросы, делают выводы.
Итак, ряд поправок:
1. правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
2. концентрированная серная кислота и азотная кислота любой концентрации реагируют с металлами по особому, при этом водород не образуется;
3. на щелочные металлы правило не распространяется, т.к. они легко взаимодействуют с водой.
Вывод: из уравнений реакций видно, что в них окислителями являются ионы водорода и ионы неметаллов, а атомы металлов – восстановители.
2.2.3. Взаимодействие металлов с растворами солей.
Показываем, какие металлы вытесняют из солей по ряду напряжений металлов.
Fe + CuSO4 → Cu + FeSO4
Запомните! В электрохимическом ряду напряжений металл, стоящий левее, может вытеснять из растворов солей металл, стоящий правее (записываем в тетрадь).
Исключение: металлы до магния не могут вытеснять другие металлы из растворов солей, так как в первую очередь реагируют с водой, образуя щелочи.
3.Свойства алюминия: Главное, ребята, вес удельный мой,
Потому в дюралях я главный составной,
Назван я «крылатым», так как самолёты
Надежно, легко отправляю в полёты.
« Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал».
Взаимодействие с кислородом.
4Al + 3O2 → 2Al2O3; (при нагревании)
Взаимодействие с галогенами.
2Al + 3Br2 → 2AlBr3; (при нагревании)
Взаимодействие с серой.
2 Al + 3S = Al2S3 (при нагревании)
Взаимодействие с азотом
2 Al +N2 = 2Al N (при нагревании)
С водородом непосредственно не реагирует.
Поскольку алюминий проявляет амфотерные свойства, то он реагирует и с кислотами и с щелочами, образуя соли. Является активным металлом, поэтому также реагирует и с водой. Почему в быту алюминий не проявляет свойства активного металла?» (поверхность алюминия покрыта оксидной пленкой).
Переходные элементы располагаются в побочных подгруппах Периодической системы Д.И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны , но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы. Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство.
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается. См. Табл. 1. Химические свойства переходных элементов довольно сложны.
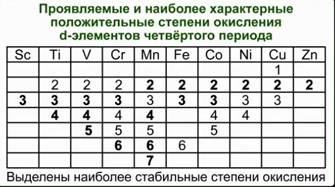
Табл. 1








