Для комплексных соединений прежде всего характерны те же свойства, что и для обычных соединений тех же классов (соли, кислоты, основания).
Если комплексное соединение кислота, то это сильная кислота, если основание, то и основание сильное. Эти свойства комплексных соединений определяются только наличием ионов H3O 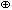 или OH
или OH 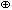 . Кроме этого комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
. Кроме этого комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
[Cu(NH3)4]SO4 + BaCl2 = BaSO4  + [Cu(NH3)4]Cl2
+ [Cu(NH3)4]Cl2
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3  + 3KCl
+ 3KCl
Другие комплексные соединения разлагаются при нагревании, например:
[ K 2 [ Zn ( OH )4] = K 2 ZnO 2 + 2 H 2 O (выше 100 o С)
41. Общая характеристика s- металлов.
Атомы s металлов имеют на внешнем электронном уровне соответственно 1 или 2 электрона ns1 или ns2.Степени окисления их ионов в большенстве случаев равны +1 и +2.По мере увеличения порядкового номера атомов растут их радиусы и уменьшаются энергии ионизации.Постые вещества имеют кристалическую решетку с относительно слабыми металлическими связями.Все s металлы,кроме бериллия,имеют невысокие значения температур плавления,твердости и прочности.
При взаимодействии с водородом s металлыобразуют ионные гидриды МН и МН2 которые в присутствии воды подвергаются гидролизу:
МН+Н2О=МОН+Н2
МН2+2Н2О=М9ОН)2+2Н2
Реакция гидролиза гидридов используется для получения водорода в автономных устройствах.Гидриды металлов также используются для получения некоторых металлов.Все s металлы кроме бериллия и магния бурно реагируют с водой с выделением водорода.
М+Н2О=МОН+1/2Н2
М+Н2О=М(ОН)2+Н2
Реакционная способность S металлов с водой возрастает с увеличением атомного номера в группе.
В следствие своей активности щелочные и щелочно-земельные металлы не могут находиться в атмосфере ,поэтому хранятся в запаяном состоянии в керосине или под слоем вазелина.Все s металлы образуют оксиды.При расстворении которых образуются щелочи.При взаимодействии с галогенами образуются хорошо расстворимые в воде нитраты этих металлов.42. p-элементы поливалентны Высшие положительные степени окисления равны номеру группы, отрицательные – числу неспаренных электронов для элементов IVА–VIIА подгрупп. Для элементов подгруппы Kr возможны только формально положительные четные степени окисления.
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие. Так, в подгруппе IVА стабильность соединений Э2+ возрастает в ряду Ge2+ < Sn2+ < Pb2+. В той же последовательности уменьшается устойчивость соединений Э4+. Подтверждением этому служит изменение термической устойчивости водородных соединений ЭH4.
Гидриды








