Если лиганды унидентатные, то координационное число равно числу таких лигандов.
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
17.2. Классификация комплексных соединений
Как химические вещества комплексные соединения делятся на ионные и молекулярные соединения. Ионные комплексные соединения содержат заряженные комплексные частицы – ионы – и являются кислотами, основаниями или солями. Молекулярные комплексные соединения состоят из незаряженных комплексных частиц (молекул).
Входящие в состав комплексных соединений комплексные частицы довольно разнообразны. Поэтому для их классификации используется несколько классификационных признаков: число центральных атомов, тип лиганда, координационное число и другие.
По числу центральных атомов комплексные частицы делятся на одноядерные и многоядерные.
17.3. Основы номенклатуры комплексных соединений
Формула комплексного соединения составляется также, как и формула любого ионного вещества: на первом месте записывается формула катиона, на втором – аниона.
Формула комплексной частицы записывается в квадратных скобках в следующей последовательности: на первом месте ставится символ элемента-комплексообразователя, далее – формулы лигандов, бывших до образования комплекса катионами, затем – формулы лигандов, бывших до образования комплекса нейтральными молекулами, и после них – формулы лигандов, бывших до образования комплекса анионами.
Название комплексного соединения строится также, как и название любой соли или основания (комплексные кислоты называются солями водорода или оксония). В название соединения входит название катиона и название аниона.
В название комплексной частицы входит название комплексообразователя и названия лигандов (название записывается в соответствии с формулой, но справа налево. Для комплексообразователей в катионах используются русские названия элементов, а в анионах – латинские.
лиганды:
| H2O – аква | Cl 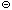 – хлоро – хлоро
| SO42 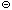 – сульфато – сульфато
| OH 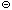 – гидроксо – гидроксо
|
| CO – карбонил | Br 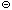 – бромо – бромо
| CO32 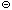 – карбонато – карбонато
| H 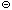 – гидридо – гидридо
|
| NH3 – аммин | NO2 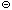 – нитро – нитро
| CN 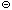 – циано – циано
| NO 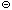 – нитрозо – нитрозо
|
| NO – нитрозил | O2 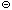 – оксо – оксо
| NCS 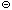 – тиоцианато – тиоцианато
| H+I – гидро |
комплексные катионы
[Zn(H2O)4]2 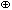 – ион тетрааквацинка – ион тетрааквацинка
| [Fe(H2O)5Cl]2 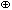 – ион хлоропентаакважелеза(III) – ион хлоропентаакважелеза(III)
|
[Ag(NH3)2] 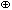 – ион диамминсеребра(I) – ион диамминсеребра(I)
| [Al(H2O)4(OH)2] 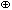 – ион дигидроксотетраакваалюминия – ион дигидроксотетраакваалюминия
|
[Cr(H2O)6]3 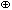 – ион гексааквахрома(III) – ион гексааквахрома(III)
| [Co(NH3)5SO3] 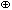 – ион сульфитопентаамминкобальта(III) – ион сульфитопентаамминкобальта(III)
|
Примеры названий комплексных анионов:
[Zn(OH)4]2 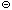 – тетрагидроксоцинкат-ион
– тетрагидроксоцинкат-ион
[Ag(S2O3)2]3 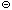 – ди(тиосульфато)аргентат
– ди(тиосульфато)аргентат
Примеры названий нейтральных комплексных частиц:
| [Fe(CO)5] – пентакарбонилжелезо | [Cr(C6H6)2] – дибензолхром |
| [Co(NH3)Cl3] – трихлороамминкобальт | [Pt(NH3)2Br2] – дибромодиамминплатина |
17.4. Химическая связь в комплексных соединениях и их строение
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
17.5. Химические свойства комплексных соединений








