Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
31. Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (С,гидр/С,общ)·100 %,где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
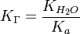 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
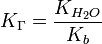 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
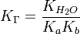
1. Гидролиз соли слабой кислоты и сильного основания: F
Na2CO3 + Н 2 О = NaHCO3 + NaOH
CO32− + H2O = HCO3− + OH−FA
(раствор имеет щелочную реакцию, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
2Al3+ + 3S2− + 6 Н 2 О = 2Al(OH)3( осадок ) + ЗН 2S( газ )
факторы, влияющие на степень гидролиза соли: природа соли, концентрация соли, температура, добавление кислоты, щелочи или других солей.
32.Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окисление - процесс отдачи электронов, с увеличением степени окисления.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
NH4NO3 → N2O + 2H2O
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (контрпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Метод электронного баланса:
MnCO 3 + KClO 3 → MnO 2 + KCl + CO
полуреакция восстановления ClV + 6e− = Cl−I
полуреакция окисления MnII − 2e− = MnIV
ClV + 6e− = Cl− * 1
MnII − 2e− = MnIV * 3
3MnCO3 + KClO3 = 3MnO2 + KCl + 3CO2
33.Электрохимические процессы – это процессы взаимного превращения химической и электрической форм энергии. Под гальваническим элементом понимают единичные ячейки химических источников тока, предназначенных для однократного электрического разряда. Гальванический элемент представляет собой два электрода различной природы и электролит. Максимальная разность потенциалов этих электродов в отсутствие электрического тока называется электродвижущей силой (э.д.с.) гальванического элемента. Э.д.с. может быть рассчитана как разность равновесных потенциалов этих электродов. Стандартный водородный электрод -это специально сконструированной электрод, в котором происходит окислительно-восстановительная реакция: 2Н+ + 2е ↔ Н2. При этом концентрация ионов водорода является одномолярной, давление водорода равняется 1 атм. и поддерживается температура 25°С
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; ΔG° = 0).
Электродный потенциал метала (E) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
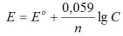
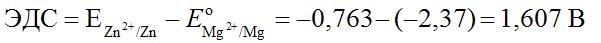
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
34. Потенциалы металлических и окислительно-восстановительных электродов.
1) При погружении металла в раствор собственных ионов устанавливается равновесие M = Mn ++ ne . При равновесии скорость растворения металла равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом металла. Для его измерения нужен гальванический элемент H 2, Pt I H + II Mn + I M pH 2=1 aH +=1 Токообразующей в этом элементе будет реакция Mn ++ n /2 H 2= M + nH +. Уравнение Нернста: EMn +/ M = E 0 Mn +/ M + RT / nF * Ln a Mn +, где a Mn + - активность ионов металла, E 0 Mn +/ M – стандартный потенциал металлического электрода.
Стандартный потенциал металлического электрода – это потенциал этого электрода в растворе собственных ионов с их активностью, равной 1. Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы (к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути).
2) К окислительно-восстановительным электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из проводника 1-го рода, контактирующего с раствором, содержащим окислители и восстановители.
Пример окислительно-восстановительного электрода – Fe 3++ e = Fe 2+. В общем виде равновесие на электроде для простых схем – Ox + ne = Red . Схема электрода соответственно может быть записана в форме Pt I Ox , Red , где Ox – окисленная форма вещества; Red – восстановленная форма вещества.
Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем. Окислительная способность систем возрастает со сдвигом редокси-потенциала в сторону положительных значений. Восстановительная способность систем растет со сдвигом потенциала в сторону отрицательных значений. Окислительно-восстановительная способность систем также зависит от активности окисленной и восстановительной форм вещества, а для реакций с участием ионов H +, OH - и от pH .
35. Электролиз расплавов и растворов. Последовательность катодных и анодных процессов. Растворимый и нерастворимый аноды. Законы Фарадея.








