Негативний вплив АФК пов'язаний з їх здатністю стимулювати утворення органічних пероксидів (ROOH). Цей процес отримав назву перекисне окиснення.
АФК найбільш активно атакують ненасичені жирні кислоти, що знаходяться у складі фосфоліпідів біомембран. Як було зазначено вище, найбільшу окислювальну здатність має гідроксильний радикал, і саме тому він ініціює ланцюг вільно-радикального окиснення. Гідроксильний радикал забирає водень у СН2-групи поліненасиченої жирної кислоти у складі фосфоліпіду і, таким чином, утворюється ліпідний радикал (L∙).
Розвиток ланцюга відбувається шляхом приєднання кисню:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•.
У результаті утворюються ліпідний пероксирадикал LOO• та пероксид ліпіду LOOH (рис. 24).
Радикали, що утворюються, мають високу реакційну здатність – кожний радикал здатний генерувати утворення декілька нових радикалів. Таким чином, виникає ланцюгова реакція перекисного окиснення ліпідів.
Одним із кінцевих продуктів ПОЛ є малоновий діальдегід:
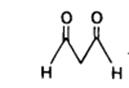
Визначення концентрації цієї сполуки у крові є важливим показником активності ПОЛ та служить маркером ендогенної інтоксикації при серцево-судинних захворюваннях, діабеті, атеросклерозі тощо.
Ланцюг вільнорадикального окиснення може бути обірваний як за рахунок взаємодії радикалів один з одним, так і в реакціях із компонентами антиоксидантної системи клітини (наприклад, вітаміном Е):
LOO• + L• → LOOH + LH;
L• + вітамін E → LH + вітамін E•;
вітамін E• + L• → LH + вітамін Еокисл.
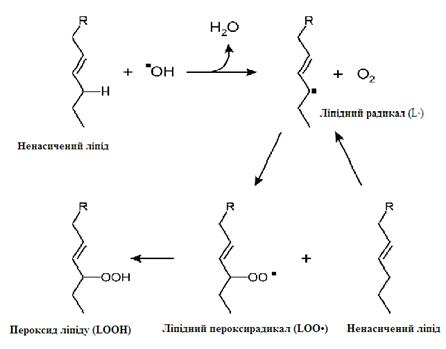
Рисунок 25 - Механізм розвитку вільнорадикальної реакції ПОЛ
Накопичення АФК та активація перекисного окиснення призводять до низки негативних наслідків у клітині:
1) порушенням рідинно-кристалічної структури ліпопроте-їнів мемебран;
2) зниження міцності та порушення структури мембран клітини, в тому числі мітохондріальної мембрани;
3) структурно-функціональні порушення ферментативних систем дихання та оксидоредуктаз;
4) порушення ферментативних систем синтезу АТФ;
5) ушкодження транспортних мембранних систем;
6) гальмування процесів синтезу білків, нуклеїнових кислот, тощо;
7) руйнація лізосом та вивільнення лізосомальних гідролітичних ферментів;
8) накопичення продуктів неповного окиснення субстратів з можливим подальшим розвитком ацидозу;
9) інактивація деяких коферментів (глутатіону, ліпоєвої кислоти).
6. Антиоксидантна система організму
Антиоксидантна система (АОС) – це потужний механізм, що запобігає розвитку лавиноподібних вільно-радикальних та перекисних реакцій в організмі. Ця система клітин організму діє завдяки наявності сполук - антиоксидантів, у складі яких міститься рухливий атом водню, що не дуже міцно з’єднаний з вуглецем (С-Н) або сіркою (S-Н). У результаті реакцій молекул антиоксидантів та вільних радикалів утворюються радикали антиоксидантів, які не є потужними окисниками й не можуть продовжувати перебіг вільно-радикальних реакцій окиснення, тобто вони обривають ці ланцюги. Радикали молекул-антиоксидантів виводяться у вигляді кінцевих продуктів, що є результатом взаємодії з молекулами інших антиоксидантів.
Антиоксиданти можуть знешкоджувати вільні радикали ще до моменту реалізації їх руйнівної дії.
Таким чином основним завданням антиоксидантної системи є зменшення кількості вільних радикалів до мінімально можливого рівня.
Усі компоненти антиоксидантної системи організму умовно поділяють на декілька груп:
1) ферменти АОС;
2) макромолекулярні неферментні сполуки;
3) низькомолекулярні неферментні сполуки (жиророз- чинні та водорозчинні антиоксиданти).
Ферменти АОС стоять на першій лінії захисту організму від шкідливої дії вільних радикалів. До них належать:
- супероксиддисмутаза (СОД);
- каталаза;
- глутатіонпероксидаза.
Супероксиддисмутаза – металофермент, який має три ізоферментні форми, що містять різні іони металів зі змінною валентністю. СОД, що містить магній, знаходиться у мітохондріях, мідьвмісна СОД – у цитозолі, цинк містить ендотеліальна СОД. Цей фермент каталізує реакцію інактивації супероксидного аніон радикала:
2 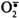 + 2H+ → H2O2 + O2.
+ 2H+ → H2O2 + O2.
У разі збільшення кількості супероксидного радикала відбувається індукція синтезу молекул СОД.
Каталаза – гемовмісний фермент, що знаходиться переважно в пероксисомах (незначна активність спостерігається також у ЕПР та цитозолі) клітин печінки (найбільша активність), нирок, еритроцитів. Цей фермент перешкоджає накопиченню перекису водню:
2Н2О2 → 2 Н2О + О2.
Каталазу відносять до ферментів з найбільшою активністю – вона здатна розщепити 44 000 молекул H2O2 за секунду. Активність каталази може бути знижена при дефіциті вітамінів (тіаміну, рибофлавіну, пантотенової кислоти, біотину, фолієвої кислоти тощо), надлишку деяких амінокислот (метіоніну, тирозину, цистеїну) та мінералів (міді, цинку).
Ферментативна пара СОД та каталаза дуже потужна і практично повністю виключає можливість вільно-радикальних реакцій, але дія різноманітних факторів внутрішнього та навколишнього середовища можуть знижувати їх ферментативну активність. Саме тому дія цих ферментів АОС не гарантує 100% захист клітин від вільних радикалів.
Глутатіонпероксидаза – фермент, що містить селен і для своєї роботи потребує наявності трипептиду глутатіону (GSH). Фермент використовує глутатіон для відновлення перекису водню (H2O2) та ліпідних гідроперекисів (LOOH) до нейтральних малотоксичних сполук:
H2O2 + 2GSH → GS-SG + 2H2O;
LOOH + 2GSH → GS-SG + LOH + H2O.
Далі окиснена форма глутатіону (GS-SG) відновлюється за допомогою глутатіонредуктази:
GS-SG + НАДФН → 2GSH - НАДФ+.
Робота глутатіонпероксидази може бути пригнічена в разі алементарного дефіциту селену. Цей мікроелемент переважно накопичуєтся у злакових культурах. У разі вирощування рослин на ґрунтах з низьким вмістом цього елемента (наприклад, у деяких регіонах України, Фінляндії, Китаю, Нової Зеландії) надходження в організм людини селену зменшується, що може мати негативні наслідки для роботи АОС та стану здоров’я людини взагалі. Дефіцит селену в організмі призводить до розвитку аліментарної м’язової дистрофії, кардіоміопатії, підвищує ризик розвитку інфаркту міокарда тощо.
Відомо, що в еритроцитах у разі високої швидкості утворення H2O2 переважає активність глутатіонпероксидази, а при низькій швидкості утворення – каталази.
Макромолекулярні неферментні сполуки АОС – це білки, що беруть участь у транспорті та зв’язуванні іонів металів зі змінною валентністю - заліза, міді, селену, кобальту (трансфе-рин, феритин, церулоплазмін, гаптоглобін, транскобаламін).
Церулоплазмін
Цей мідьвмісний білок крові є універсальним позаклітинним гасником вільних радикалів. Церулоплазмін має су пероксид-дисмутазну активність і, таким чином, захищає ліпіди мембран від окиснення. Важливою функцією церулоплазміну є знешкод-ження вільних радикалів, що генеруються та вивільняються у кров макрофагами під час фагоцитозу. Крім того, цей білок інактивує вільні радикали, які утворюються у місцях запалення.
Опосередкована антиоксидантна дія цитохрому пов’язана з транспортом міді від печінки до тканин. Активність такого клітинного ферменту АОС як супероксиддисмутаза залежить від наявності саме цього мікроелемента.
Низькомолекулярні неферментні сполуки АОС поділяють на дві групи:
1. Жиророзчинн і, які ще називають «істинними» (інактивують вільні радикали).
2. Водорозчинні , які належать до допоміжних антиоксидантів (у тому числі відновлюють «істинні» антиоксиданти).








