На рис. 20 наведена структура протонної АТФ-синтази (Н+-АТФ-синтази, Н+-АТФ-аза), яка безпосередньо використовує енергію протонного градієнта, що був створений дихальним ланцюгом, для синтезу АТФ.
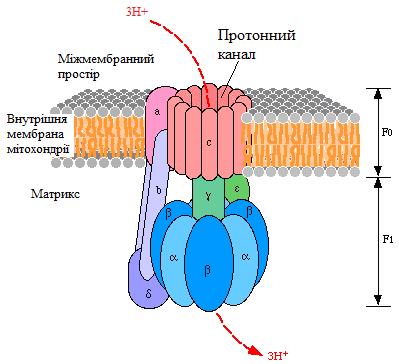
Рисунок 20 - Структура Н+-АТФ-синтази
Протонна АТФ-синтаза – це олігомерний білок, який вмонтований у внутрішню мембрану мітохондрії і за будовою нагадує гриб (рис. 19). Вона містить дві субодиниці:
Fo – протонний канал (о - від «олігоміцин»); лише через цей канал протони можуть повернутися в матрикс;
F1 – фермент, який використовує енергію, що вивільняється при транспорті протонів через Fo для синтезу АТФ з АДФ та Фн.
П.Мітчелл у своїй теорії теоретично віддав функцію спряження окиснення та фосфорилювання саме Н+-АТФ-азі. Експериментальне піддтердження цей факт знайшов у працях Джона Уокера та Пола Бойера, які за «З’ясування ензимного механізму, що лежить в основі синтезу аденозин-фосфату» в 1997 році отримали Нобелівську премію з хімії.
На сьогодні відомо, що при транспорті протонів через Fo-субодиницю відбуваються конфірмаційні зміни в активному центрі F1-субодиниці, які призводять до її активації і відповідно до синтезу АТФ та її вивільнення. Молекули АТФ, що синтезуються, транспортуються у цитозоль за допомогою транслокази.
Для синтезу молекули АТФ, її вивільнення та транспорту у цитозоль потрібна енергія 4 протонів (40% цієї енергії іде на синтез АТФ, 60% виділяється у вигляді тепла).
Кількість молекул неорганічного фосфату, яке перейшло у зв’язану форму (тобто у АТФ) у перерахунку на один атом кисню має назву коефіцієнт окисного фосфорилювання і позначається Р/ O (коефіцієнт фосфорилювання).
Коефіцієнт Р/O чисельно дорівнює кількості молекул АТФ, що синтезувалися в результаті транспорту 2 ē на один атом кисню. Тому для субстратів, що окислюються під дією НАД-залежних дегідрогеназ Р/ O = 3 (наприклад, для пірувату, α-кетоглутарату, ізоцитрату, малату). Для субстратів, які окислюються за допомогою ФАД-залежних дегідрогеназ, цей коефіцієнт дорівнює 2 (наприклад, для сукцинату, ацил-КоА, гліцерил-3-фосфату).
4.5. Інгібітори та роз’єднувачі окисного фосфорилювання
Робота протонної АТФ-синтази може бути порушена за наявності в клітині сполук – інгібіторів окисного фосфорилювання. Так, наприклад, олігоміцин пригнічує роботу Fo субодиниці і, таким чином, робить неможливим використання енергії протонного градієнта для синтезу АТФ.
Деякі речовини роз’єднують окиснення та фосфорилювання, тому мають назву роз’єднувачів окисного фосфорилювання. Ці сполуки ліпофільні, легко дифундують через внутрішню мембрану мітохондрій, можуть зв’язувати протони та переносити їх у матрикс за градієнтом концен-трацій Н+ (тому вони належать до сполук протонофорів).
У разі наявності в клітині роз’єднувача окиснення субстратів відбувається дуже активно, дихальний ланцюг мітохондрій працює і намагається створити електрохімічний градієнт протонів, але цього не відбувається. Пояснення в тому, що молекули роз’єднувача захоплюють протони з міжмемб-ранного простору і транспортують їх у матрикс. За таких умов окиснення субстратів не приводить до створення протонного градієнта і, відповідно, до синтезу АТФ. Енергія окиснення перетворюється в теплову енергію, тобто коефіцієнт окисного фосфорилювання знижується і спостерігається виділення тепла (пірогенна дія).
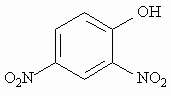
Класичним прикладом роз’єднувача є 2,4-динітрофенол:
Крім 2,4-динітрофенолу до синтетичних роз’єднувачів потрібно віднести деякі похідні вітаміну К, анестетики, антибіотики валіноміцин та граміцидин, ацетилсаліцилову кислоту, гербіциди. До природних роз’єднувачів належать продукти перикисного окиснення ліпідів, довголанцюгові жирні кислоти, великі дози териоїдних гормонів.
Саме тому в людей, які хворіють на гіпертиреоз спостерігається підвищення температури тіла, активне окиснення субстратів і тому, незважаючи на підвищений апетит, вони втрачають вагу. Відомо також, що в разі купання у холод-ній воді в організмі людей-моржів спостерігається підсилена секреція тиреоїдних гормонів, що, у свою чергу, дозволяє підсилити термопродукцію і покращити терморегуляцію .
Прикладом природного роз’єднання також може бути робота білка термогеніну, який знаходиться у внутрішній мембрані мітохондрій бурої жирової тканини. Цей білок є протонним каналом, через який транспортуються протони у матрикс і тому робота дихального ланцюга не може створити необхідний електрохімічний градієнт протонів для синтезу АТФ. Тому активне окиснення субстратів бурою жировою тканиною призводить до генерації теплової енергії.

4.6. Дихальний контроль
Процес синтезу АТФ залежить від енергетичного статусу клітини, який, у свою чергу знаходить своє вираження у кількісному співвідношенні АТФ/АДФ. При зростанні потреб клітини в енергії підвищується концентрація АДФ і значення цього співвідношеня знижується. Це супроводжується активацією тканинного дихання і, відповідно, окисного фосфорилювання.
Процес залежності дихання клітин від вмісту аденілових нуклеотидів був вивчений in vitro. Результати дослідження показали, що за наявності в середовищі всіх компонентів, за винятком АДФ, поглинання кисню клітиною не відбувається. Внесення в інкубаційну суміш АДФ стимулює дихання, активність якого знижується при зростанні концентрації АТФ. Швидкість дихання знижується до нуля, коли вся АДФ перетворюється в АТФ. Тому залежність роботи дихального ланцюга від співвідношення АТФ/АДФ отримала назву дихальний контроль. Механізм дихального контролю відрізняється високою точністю і швидко реагує навіть на невеликі зміни концентрацій АТФ та АДФ. Незначне підвищення концентрації АДФ призводить до активації дихання та фосфорилювання.
Зниження синтезу АТФ призводить до розвитку гіпоенергетичного стану в організмі. Синтез АТФ знижується при:
1) гіпоксії;
2) голодуванні, дефіциті деяких вітамінів (В1, В2, РР) та мінералів (Fe, Cu);
3) наявності інгібіторів дихального ланцюга та інгібіторів окисного фосфорилювання;
4) наявності роз’єднувачів окиснення та фосфорилювання.
АТФ не депонується в клітинах організму, постійно відбу-вається синтез та розпад молекул цього нуклеозидтрифосфату. Загальний вміст АТФ в організмі - 30-50 г, але час «життя» молекули АТФ – менше 1 хв. За добу в організмі людини синтезується та розщеплюється 40-60 кг АТФ.
5. Шляхи використання кисню в організмі
В організмі людини існує чотири типи шляхів (відповідно реакцій) використання кисню:
1. Оксидазний шлях
Реакції цього шляху використовують 80-90% усього кисню, який споживає організм. Усі процеси, описані вище і стосуються аеробного розщеплення основних паливних молекул до води та СО2 з утворенням АТФ, належать саме до цього шляху.
2 . Оксигеназн ий шлях
Споживання кисню в реакціях цього шляху знаходиться в межах 8-12% . Цей тип окиснення субстратів не пов'язаний з синтезом АТФ. Ферменти, які каталізують відповідні реакції, мають назву оксигенази.
Оксигенази – це ферменти класу оксидоредуктаз. Залежно від кількості атомів кисню, які входять до молекули субстрату під дією оксигеназ, виділяють монооксигенази та диоксигенази. Монооксигенази є гідроксилазами – вони вводять до складу субстрату один атом кисню (гідроксилюють субстрат), другий - відновлюється до молекули води:
SH + O 2 + НАДФН⋅Н+ → S-OH + H2O + НАДФ+.
Диоксигенази включають обидва атоми кисню в молекулу субстрату:
S + O 2 → SO 2 .
Оксигенази є гемовмісними білками, які знаходяться у мік-росомальній фракції печінки (ендоплазматичному ретикулумі), наднирниках тощо. Найбільш поширені монооксигенази. Ці ферменти зазвичай беруть участь у синтезі, біотрансфор-мації та розпаді метаболітів. Функціонування монооксигеназ надає анаболічної функції кисню, тому що він не використовується з метою окиснення субстратів і синтезу АТФ. Кисень включається в процеси перетворення субстратів і його введення в структуру молекул змінює фізико-хімічні та біологічні властивості сполук.
Основною монооксигеназою організму є цитохром Р450, який гідроксилює субстрати, такі як холестерол (при синтезі жовчних
кислот та стероїдних гормонів), лікарські сполуки (при їх інактивації в печінці), різноманітні ксенобіотики та ендогенні токсичні речовини (при їх знешкодженні в печінці) тощо. Окиснення, яке відбувається за участі цитохрому Р450, має назву мікросомальне окиснення.
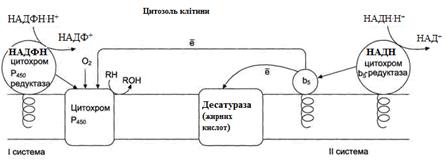
Рисунок 21 – Електрон-транспортні ланцюги мікросомального окиснення: I система – НАДФН-цитохром Р450 редуктазна;
II система – НАДН-цитохром b5 редуктазна.
Мікросомальне окиснення відбувається за участі електрон-траспортних ланцюгів, які містять білки-переносники, що вбудовані в мембрани. Існують два ланцюги (на рис. 20 – системи):
I – до складу входить два ферменти: НАДФН⋅Н+-цитохром Р450 редуктаза та цитохром Р450. НАДФН⋅Н+-цитохром Р450 редуктаза містить два коферменти ФАД та ФМН, які беруть участь у транспорті електронів з НАДФН⋅Н+ на цито-хром Р450 (рис. 22). Цитохром Р450 каталізує гідроксилювання субстратів.
II – містить фермент НАДН-цитохром b5 редуктазу та цитохром b5. Коферментом НАДН-цитохром b5 редуктази є ФАД, який бере участь у транспорті електронів з НАДН⋅Н+ на цитохром b5 (рис. 23). Наступним акцептором електронів може бути десатураза (цей фермент вводить подвійний зв'язок у структуру жирних кислот) або цитохром Р450 (рис. 21).
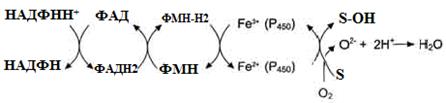
Рисунок 22 - Схема електрон-транспортного ланцюга НАДФН-цитохром Р450 редуктазної системи
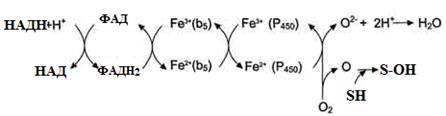
Рисунок 23 - Схема електрон-транспортного ланцюга НАДН-цитохром b5 редуктазної системи
Цитохром Р450 належить до групи гемопротеїнів, які можуть зв’язувати СО. Саме після зв’язування з монооксидом вуглецю цей цитохром має максимум поглинання світла при довжині хвилі 450 нм і тому отримав назву Р450. Печінка та нирки містять різний ізоферментний спектр цього цитохрому. На сьогодні відомо приблизно 150 генів цитохрому Р450.
Група цитохромів Р450 має низьку субстратну специфічність – вони можуть каталізувати гідроксилювання різноманітних сполук і тому їх називають оксидазами мішаної функції.
Синтез цитохрому Р450 може бути індукований різноманітними сполуками – індукторами. Відомо приблизно 250 хімічних речовин, які індукують синтез ферментів мікросомального окиснення (барбітурати, спирти, кетони, деякі стероїди).
3 . Пероксидазн ий шлях
Це шлях відновлення кисню до пероксиду водню або супероксидного аніон-радикалу за допомогою флавопротеїнів, які здатні до аутоокиснення, наприклад, ксантиноксидаза, алкогольдегідрогеназа та ін. Це відбувається при аутоокисненні гемоглобіну, фередоксинів, гідрохінонів, які відновлені цитохромом b5, біогенних амінів, амінокислот.
Цей шлях є побічним шляхом окиснення, зазвичай спостерігається під час виходу з ладу цитохромної системи або коли субстрат не окислюється іншим шляхом (наприклад, сечовина).
При активації цього шляху велика кількість перекису водню та супероксидного аніон-радикалу стає небезпечною для клітин і тому знешкоджується за допомогою спеціальних ферментатив-них систем антиоксидантного захисту.








