Санкт-Петербургский государственный
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
по лабораторной работе №2
по дисциплине «Химия»
Тема: Определение молярной массы эквивалента металла
| Студентка гр. 6181 | Федорова Д.А. | |
| Преподаватель | Завьялова А.Ю. |
Санкт-Петербург
2017
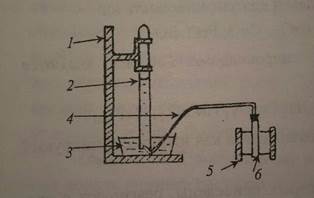
Цели работы: определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл. Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты приведена на рис. 3.1, где обозначены: 1 - штатив для эвдиометра; 2 - эвдиометр; 3 - кристаллизатор; 4 - газоотводная трубка; 5 - штатив для пробирки; 6 - пробирка.
Основные теоретические положения
Основными структурными единицами вещества являются атомы, молекулы, ионы, эквиваленты.
Эквивалент – реальная частица (атом, молекула, ион) или условная частица (доля атома, молекулы, иона), равноценная одному иону водорода 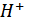 в кислотно-основных реакциях или одному электрону
в кислотно-основных реакциях или одному электрону 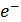 в окислительно- восстановительных реакциях. Обозначается Э (вещество).
в окислительно- восстановительных реакциях. Обозначается Э (вещество).
Молярная масса эквивалента вещества – масса 1 моль ( 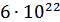 ) эквивалентов данного вещества. Обозначается
) эквивалентов данного вещества. Обозначается 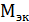 (вещество). Выражается в граммах на моль [г/моль].
(вещество). Выражается в граммах на моль [г/моль].
Для окислительно-восстановительной реакции, идущей в работе, закон эквивалентов можно записать как
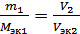 ,
,
где 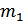 и
и 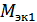 - масса и молярная масса вещества 1;
- масса и молярная масса вещества 1; 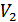 и
и 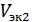 - объем и молярный объем эквивалентов газообразного вещества 2.
- объем и молярный объем эквивалентов газообразного вещества 2.
Молярная масса эквивалента металла-восстановителя имеет вид
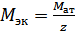 ,
,
где 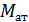 - молярная масса атомов металла, г/моль;
- молярная масса атомов металла, г/моль; 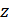 – число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции
– число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции
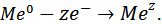
Математическая обработка результатов данных
1. Приведем объем выделившегося водорода к нормальным условиям (н.у.):
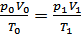 ;
; 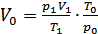 ,
,
где 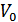 - объем выделившегося водорода;
- объем выделившегося водорода; 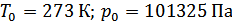 ;
; 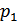 - парциальное давление водорода в условиях опыта;
- парциальное давление водорода в условиях опыта; 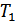 – температура опыта.
– температура опыта.
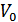 =
= 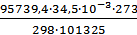
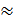 0,03 л
0,03 л
2. Рассчитаем молярную массу эквивалента металла, используя закон эквивалентов:
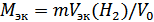 ,
,
где 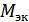 - молярная масса эквивалента металла, г/моль; m – навеска металла;
- молярная масса эквивалента металла, г/моль; m – навеска металла; 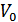 – объем выделившегося водорода (н. у.);
– объем выделившегося водорода (н. у.); 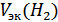 = 11.2 л/моль (н. у.)
= 11.2 л/моль (н. у.)
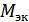 =
= 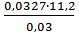 =12,208 г/моль
=12,208 г/моль
3. Определим молярную массу атомов металла
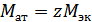
методом подстановки находим 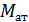 =24,416 г/моль. Отсюда следует, что данный металл – магний.
=24,416 г/моль. Отсюда следует, что данный металл – магний.
4. Вычислим абсолютную ( 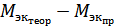 ) [г/моль] и относительную
) [г/моль] и относительную 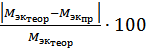 [%] погрешности определения, где
[%] погрешности определения, где 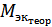 - теоретическая молярная масса атомов металла.
- теоретическая молярная масса атомов металла.
Абсолютная погрешность: ( 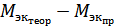 ) = 12,1525 – 12,208 = -0,0555 г/моль.
) = 12,1525 – 12,208 = -0,0555 г/моль.
Относительная погрешность: 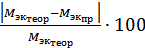 =
= 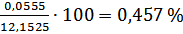 .
.
5. Приведем уравнение окислительно-восстановительной реакции
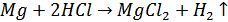
Вывод: определили молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты, экспериментальным путем получен эквивалент массы магния, равный 12,208 г/моль. Это значение не расходится с теоретическим значением.








