VI. Исследование вопроса о направлении реакции при температуре реакции T 3 и давлении P .
Пусть в реакции
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1 | 1/6 |
| H2S | 1 | 1/6 |
| CS2 | 2 | 1/3 |
| H2O | 2 | 1/3 |
Как было выявлено выше, давления в уравнении константы равновесия сокращаются, следовательно, мольные доли реагентов не зависят от давления.
Выражаем константу равновесия:
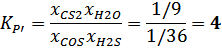
Чтобы определить равновесие реакции, запишем формулу изменения энергии Гиббса:
Δ GT 3 = Δ G ˚ T 3 + RT 3 ln ( Kp ’ )
Подставляем численные значения:
Δ GT 3 = 59931,939 + 2200*8.31* ln (4) = 85276,173 Дж
Энергия Гиббса больше нуля, следовательно, равновесие реакции будет смещено влево, в сторону образования исходных веществ.
VII. Термодинамический анализ выхода реакции от давления и температуры.
От температуры:
Как видно, в графике изменения константы равновесия от температуры, KP увеличивается. Так как уравнение KP имеет вид:
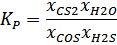
Значит, что мольные доли продуктов реакции увеличиваются, а реагентов – уменьшаются. Следовательно, чтобы повысить выход реакции, нужно повысить температуру.
Это объяснимо, с точки зрения закона Ле-Шателье – приведённая реакция эндотермическая, так как ΔH˚298>0. При повышении температуры, равновесие сместится в сторону образования продуктов, чтобы ослабить внешнее воздействие против увеличения температуры.
От давления:
Перепишем реакцию: COS+H2S=CS2+H2O
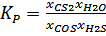
Константа равновесия от давления не зависит, но при изменении P, мольные доли веществ постоянны, следовательно, давление на выход реакции не влияет.
VIII. Расчёт теплового эффекта достижения состояния равновесия реакционными смесями.
a) Реагирует стехиометрическая смесь исходных веществ
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1-z | (1-z)/2 |
| H2S | 1-z | (1-z)/2 |
| CS2 | z | z/2 |
| H2O | z | z/2 |
Нам известно, что
z = 0,1622 моль
ΔH˚2200=30761,651 Дж/моль.
Следовательно, ΔH2200= 0,1622 * 30761,651 = 4989,54 Дж.
Реакция эндотермическая
b) Реагирует стехиометрическая смесь всех веществ
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1-z | (1-z)/4 |
| H2S | 1-z | (1-z)/4 |
| CS2 | 1+z | (z+1)/4 |
| H2O | 1+z | (z+1)/4 |
Нам известно, что
z = – 0,6755 моль
ΔH˚2200=30761,651 Дж/моль.
Следовательно, ΔH2200= – 0,6755 * 30761,651 = -20779,5 Дж.
Реакция экзотермическая
IX. Расчёт условий P и T ( температур в интервале 1500-2500 К с шагом 100 К) , при которых сумма мольных долей газообразных продуктов составит не менее 0,8 при реакции стехиометрической смеси исходных веществ.
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1-z | (1-z)/2 |
| H2S | 1-z | (1-z)/2 |
| CS2 | z | z/2 |
| H2O | z | z/2 |
Составляем неравенство, где нужно найти z:
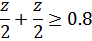
В результате, выходит, что z 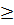 0.8 моль, так как двойки в выражении сократятся. Подставляем выражение в уравнение константы равновесия:
0.8 моль, так как двойки в выражении сократятся. Подставляем выражение в уравнение константы равновесия:
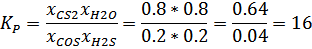
Стоит в очередной раз заметить, что мольные доли не зависят от давления, только от температуры среды, где реагирует газовая смесь COS и H2S








