III. Точный расчёт термодинамических функций в интервале T 1 – T 2
Вариант 16
Дано:
Уравнение реакции: COS+H2S=CS2+H2O
T1=1500 К
T2=2500 К
T3=2200 К
Р=2 атм.
Термодинамические данные:
| вещество | Агрегатное состояние | ΔH˚298 Дж/моль | ΔS˚298 Дж/(моль*К) | Cp=a+bT+cT-2 | ||
| a (Дж/К) | b*103 (Дж/K2) | c*10-5 (Дж/К) | ||||
| COS | g | -141700 | 231.54 | 48.12 | 8.45 | -8.20 |
| CS2 | g | 116700 | 237.77 | 52.09 | 6.69 | -7.53 |
| H2S | g | -29600 | 205.69 | 29.37 | 15.40 | 0.00 |
| H2O | g | -241810 | 188.72 | 30.00 | 10.71 | 0.33 |
I. Расчёт Δ H ˚298, Δ S ˚298, ΔСр химической реакции по таблицам стандартных химических величин.
-- По закону Гесса, тепловой эффект химической реакции определяется только начальным и конечным состоянием вещества. ΔH реакции равен разности сумм энтальпий продуктов и реагентов реакции
ΔH˚298=( ΔH˚298(CS2)+ ΔH˚298(H2O)) - (ΔH˚298(H2S) +ΔH˚298(COS))
ΔH˚298=(116700 - 241810) - (-29600 – 141700)= 37190 Дж/моль
-- Изменение энтропии реакции равно, как и в первом случае, разности сумм энтропий продуктов и реагентов:
ΔS˚298=( ΔS˚298(CS2)+ ΔS˚298(H2O)) - (ΔS˚298(H2S) +ΔS˚298(COS))
ΔS˚298=(237.77 - 188.72) - (205.69 + 231.54)= -10,74 Дж/ ( моль * К)
-- Теплоёмкость вещества выражается в уравнении Cp=a+bT+cT-2, следовательно, ΔСр тоже функция температуры, выражающаяся как:
ΔCp=Δa+ΔbT+ΔcT-2 => Δ Cp = 4.60 -6.45* 10-3 T +105 * T -2
II. Результаты расчёта термодинамических функций Δ H ˚ T , Δ S ˚ T , Δ G ˚ T и ln ( KP )
a) ΔCp=0
ΔH˚T = ΔH˚298= 37190 Дж/моль
ΔS˚T = ΔS˚298= -10,74 Дж/(моль*К)
ΔG˚T = ΔH˚T – T*ΔS˚T
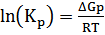
| T,К | ∆H,Дж | ∆S,Дж/К | ∆G,Дж | lnKp | ∆Cp,Дж/(моль*К) | Kp |
| 1500 | 37190 | -10,74 | 53300 | -4,276 | 0 | 0,014 |
| 1600 | 37190 | -10,74 | 54374 | -4,090 | 0 | 0,017 |
| 1700 | 37190 | -10,74 | 55448 | -3,925 | 0 | 0,020 |
| 1800 | 37190 | -10,74 | 56522 | -3,779 | 0 | 0,023 |
| 1900 | 37190 | -10,74 | 57596 | -3,648 | 0 | 0,026 |
| 2000 | 37190 | -10,74 | 58670 | -3,530 | 0 | 0,029 |
| 2100 | 37190 | -10,74 | 59744 | -3,424 | 0 | 0,033 |
| 2200 | 37190 | -10,74 | 60818 | -3,327 | 0 | 0,036 |
| 2300 | 37190 | -10,74 | 61892 | -3,238 | 0 | 0,039 |
| 2400 | 37190 | -10,74 | 62966 | -3,157 | 0 | 0,043 |
| 2500 | 37190 | -10,74 | 64040 | -3,083 | 0 | 0,046 |
b) ΔCp= ΔC298 = 4.60 -6.45* 10-3 T + T -2 (T= 298 K)
ΔC298 = 3,804
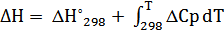
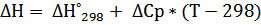
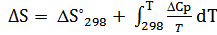
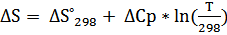
| T,К | ∆H,Дж | ∆S,Дж/К | ∆G,Дж | lnKp | ∆Cp,Дж/(моль*К) | Kp |
| 1500 | 41762,378 | -4,592 | 48650,818 | -3,903 | 3,804 | 0,020 |
| 1600 | 42142,776 | -4,347 | 49097,640 | -3,693 | 3,804 | 0,025 |
| 1700 | 42523,174 | -4,116 | 49520,672 | -3,505 | 3,804 | 0,030 |
| 1800 | 42903,571 | -3,899 | 49921,314 | -3,337 | 3,804 | 0,036 |
| 1900 | 43283,969 | -3,693 | 50300,813 | -3,186 | 3,804 | 0,041 |
| 2000 | 43664,366 | -3,498 | 50660,281 | -3,048 | 3,804 | 0,047 |
| 2100 | 44044,764 | -3,312 | 51000,722 | -2,923 | 3,804 | 0,054 |
| 2200 | 44425,161 | -3,135 | 51323,041 | -2,807 | 3,804 | 0,060 |
| 2300 | 44805,559 | -2,966 | 51628,064 | -2,701 | 3,804 | 0,067 |
| 2400 | 45185,956 | -2,804 | 51916,542 | -2,603 | 3,804 | 0,074 |
| 2500 | 45566,354 | -2,649 | 52189,166 | -2,512 | 3,804 | 0,081 |
c) ΔCp= ΔCp((T1+T2)/2)= ΔCp(2000)
Cp= -8,275
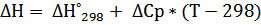
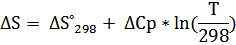
| T,К | ∆H,Дж | ∆S,Дж/К | ∆G,Дж | lnKp | ∆Cp,Дж/(моль*К) | Kp |
| 1500 | 28915,00 | -24,113 | 65085,175 | -5,221 | -8,275 | 0,005 |
| 1600 | 26415,95 | -24,648 | 65851,960 | -4,953 | -8,275 | 0,007 |
| 1700 | 25588,45 | -25,149 | 68342,048 | -4,838 | -8,275 | 0,008 |
| 1800 | 24760,95 | -25,622 | 70880,840 | -4,739 | -8,275 | 0,009 |
| 1900 | 23933,45 | -26,070 | 73465,628 | -4,653 | -8,275 | 0,010 |
| 2000 | 23105,95 | -26,494 | 76093,989 | -4,578 | -8,275 | 0,010 |
| 2100 | 22278,45 | -26,898 | 78763,742 | -4,513 | -8,275 | 0,011 |
| 2200 | 21450,95 | -27,283 | 81472,914 | -4,456 | -8,275 | 0,012 |
| 2300 | 20623,45 | -27,651 | 84219,713 | -4,406 | -8,275 | 0,012 |
| 2400 | 19795,95 | -28,003 | 87002,502 | -4,362 | -8,275 | 0,013 |
| 2500 | 18968,45 | -28,341 | 89819,780 | -4,323 | -8,275 | 0,013 |
III. Точный расчёт термодинамических функций в интервале T 1 – T 2
Пусть
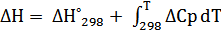 ,
,
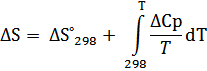
При этом,
ΔCp= 4.60 -6.45* 10-3 T +105 * T -2
Значит:
Δ H ˚ T = Δ H ˚298 + (4.60*( T -298) -3.225* 10-3 *( T 2 – 2982) -5*104 *( T -1 – 298-1))
Δ S ˚ T = Δ S ˚298 + (4.60* ln ( T /298) – 6.45*10-3*( T -298) - 3.33*104 *( T -2 – 298-2))
| T,К | ∆H,Дж | ∆S,Дж/К | ∆G,Дж | lnKp | ∆Cp,Дж/(моль*К) | Kp |
| 1500 | 35883,795 | -10,518 | 51660,646 | -4,144 | -4,235 | 0,0159 |
| 1600 | 35346,128 | -10,863 | 52727,460 | -3,966 | -4,885 | 0,0190 |
| 1700 | 34743,716 | -11,227 | 53830,006 | -3,810 | -5,534 | 0,0221 |
| 1800 | 34076,600 | -11,607 | 54969,977 | -3,675 | -6,183 | 0,0254 |
| 1900 | 33344,812 | -12,002 | 56148,879 | -3,556 | -6,831 | 0,0285 |
| 2000 | 32548,378 | -12,410 | 57368,060 | -3,452 | -7,479 | 0,0317 |
| 2100 | 31687,319 | -12,829 | 58628,731 | -3,360 | -8,126 | 0,0347 |
| 2200 | 30761,651 | -13,259 | 59931,989 | -3,278 | -8,773 | 0,0377 |
| 2300 | 29771,389 | -13,699 | 61278,831 | -3,206 | -9,420 | 0,0405 |
| 2400 | 28716,545 | -14,147 | 62670,167 | -3,142 | -10,067 | 0,0432 |
| 2500 | 27597,128 | -14,604 | 64106,830 | -3,086 | -10,713 | 0,0457 |
V. Расчёт равновесных составов
a) При случае реакции только начальных стехиометрических компонентов реакции.
В данной реакции все вещества – газы. Значит, уравнение константы равновесия имеет вид:
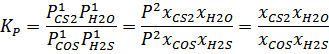
Следовательно, мольные доли участников реакции не зависят от общего давления, так как оно в формуле сокращается.
Нам заданы условия:
T 3 =2200 К
Р=2 атм.
Значение константы равновесия вычисляется по формуле:
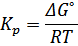
В случае T3 оно равно 0,0377
Вычислим мольные доли:
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1-z | (1-z)/2 |
| H2S | 1-z | (1-z)/2 |
| CS2 | z | z/2 |
| H2O | z | z/2 |
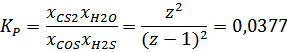
В результате решения этого уравнения, мы находим число z, равное 0,1622 молям. Значит, равновесные количества, мольные
доли и массовые проценты веществ таковы:
| вещество | количество (моль) | мольные доли | молярная масса (г/моль) | масса вещества (граммы) | массовые проценты |
| COS | 0.8378 | 0.4189 | 60 | 50 .268 | 0.412 |
| CS2 | 0.8378 | 0.4189 | 76 | 63.673 | 0.522 |
| H2S | 0,1622 | 0.0811 | 34 | 5.515 | 0.045 |
| H2O | 0,1622 | 0.0811 | 18 | 2.92 | 0.021 |
b) При случае реакции всех стехиометрических компонентов реакции .
Нам заданы условия:
T 3 =2200 К
Р=2 атм.
Выражаем значение z:
COS+H2S=CS2+H2O
| вещество | количество вещества (моль) | мольные доли |
| COS | 1-z | (1-z)/4 |
| H2S | 1-z | (1-z)/4 |
| CS2 | 1+z | (1+z)/4 |
| H2O | 1+z | (1+z)/4 |
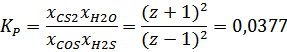
В этом случае z будет равен – 0,6755 моль. Это значит, что реакция сместилась влево, с образованием начальных компонентов реакции.
| вещество | количество (моль) | мольные доли | молярная масса (г/моль) | масса вещества (граммы) | массовые проценты |
| COS | 1 . 6755 | 0.4189 | 60 | 100 .53 | 0.411 |
| CS2 | 1 . 6755 | 0.4189 | 76 | 127.338 | 0.520 |
| H2S | 0 . 3245 | 0.0811 | 34 | 11.033 | 0.046 |
| H2O | 0 . 3245 | 0.0811 | 18 | 5.841 | 0.023 |








