Теория электролитической диссоциации.
Теория электролитической диссоциации даёт, предложенная шведским учёным С. Аррениусом в конце XIX века на основе количественного экспериментального исследования электропроводимости растворов, объясняет существование подвижных ионов в растворах электролитов.
Аррениус пришёл к выводу, что в растворе в отсутствие электрического тока существует равновесие между активной частью электролита, возникающей в результате его диссоциации на ионы, способные переносить электрический ток, и недиссоциированной неактивной частью, не проводящей тока.
В науку было введено понятие степени диссоциации растворённого вещества. Степень диссоциации α равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворённого вещества.
Для случая электролита, диссоциирующего на два иона, например
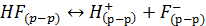
При общей аналитической молярной концентрации фтороводорода, равной C, степень диссоциации α равна
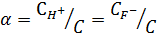
Основные положения теории электролитической диссоциации:
1.
В растворах электролитов происходит самопроизвольный распад – диссоциация молекул на ионы, в результате чего раствор становится электропроводящим. Степень диссоциации α, определяет молярную электропроводимость.
2.
Осмотическое давление, температуры плавления и кипения растворов электролитов зависят не только от аналитической концентрации электролита, но и от степени его диссоциации.
3.
Для одного и того же растворённого вещества степень диссоциации увеличивается по мере разбавления раствора.
электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при растворении веществ с ионной структурой, в другом - при растворении веществ с полярной связью.
Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью.Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происходит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым движением молекул воды приводит к распаду полярной молекулы на ионы
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации вгомогенных (однородных) системах]
Степень диссоциации равна отношению числа продиссоциированных молекул вещества 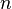 к общему числу его молекул
к общему числу его молекул 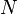 . Выражается в долях или процентах.
. Выражается в долях или процентах.
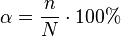
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.








