Если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этою воздействия.
Так, согласно принципу Ле Шателье, введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.
Процесс будет идти до тех пор, пока система не придет к состоянию равновесия. В этом новом состоянии химического равновесия концентрации (парциальные давления) всех веществ отличны от начальных, но соотношение между ними, выражаемое константой равновесия, остается тем же. Таким образом, в системе, находящейся в равновесии, нельзя изменить концентрацию какого-нибудь из реагентов, не вызывая изменения концентрации всех остальных.
Изменение давления
Повышение давления сдвигает равновесие в сторону реакций, идущих с уменьшением объема, то есть в ту сторону, где меньше молей в уравнении реакции. Снижение давления действует обратным способом.
Изменение температуры
Повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением теплоты, а понижение температуры действует в противоположном направлении.
Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
Вопрос 19
Влияние концентраций веществ на скорость химической реакции
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов. Это можно продемонстрировать с помощью модели.
В середине XIX в. (1865 г. - Н.Н.Бекетов, 1867 г. - К.Гульдберг, П.Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс:
| Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени: v = k[A]n[B]m, для реакции aA + bB = ... |
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.Обратите внимание, что степени при концентрациях А и В в общем случае не равны стехиометрическим коэффициентам в реакции! Они становятся численно равными только в том случае, если реакция протекает именно так, как записывается (такие реакции называются простымиили элементарными и достаточно редки). В большинстве случаев уравнение реакции отражает лишь суммарный результат химического процесса, а не его механизм.
Коэффициент пропорциональности k называется константой скорости реакции. Значение константы скорости реакции постоянно для данной реакции при данной температуре.
*В закон действующих масс не входят концентрации твердых веществ, т.к. реакции с твердыми веществами протекают на их поверхности, где "концентрация" вещества постоянна.
Cтв+O2=CO2,
v=k[C]m[O2]n=k'[O2]n; k'=k[C]m
авление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.В уравнении Менделеева-Клапейрона:pV = nRT перенесем V в правую часть, , а RT - в левую и учтем, что n/V = c:p/RT = c Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.Необычно зависит от давления скорость разветвленных цепных реакций.
Пока что для простоты рассматривались гомогенные реакции, т.е. реакции, которые протекают в однородной среде, например, в смеси газов или в растворе. Но существует множество гетерогенныхпроцессов, идущих на поверхности соприкосновения:
твердого вещества и газа: S + O2 = SO2,
твердого вещества и жидкости: Fe + 2HCl = FeCl2 + H2,
двух несмешивающихся жидкостей: C3H7Br + KCN (водн.) = C3H7CN + KBr(водн.)
Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов.*Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление.Скорость химической реакции. Определение.Химические реакции протекают с разными скоростями. Из известных на сегодняшний день реакций самая быстрая протекает в 1040 раз быстрее, чем самая медленная. Превращение графита в алмаз в недрах Земли - очень медленная реакция. А взрыв смеси кислорода с водородом происходит практически мгновенно.Скорость - это изменение некоторой величины во времени.Рассмотрим реакцию:H2 + I2 = 2HIПопробуем определить скорость этой реакции по расходованию реагентов в единицу времени. Например, так:v(H2) = m(H2)/Dt, v(I2) = m(I2)/Dtгде v - скорость реакции, m - убыль массы соответствующего реагента, Dt - отрезок времени.Но v(H2) не равно v(I2). Ведь массы водорода и иода, прореагировавших в единицу времени, не равны.Реакция идет в мольном соотношении 1:1, а не в массовом! Попробуем по-другому:v(H2) = n(H2)/Dt, v(I2) = n(I2)/Dtвзяв вместо масс количества веществ.v(H2) = v(I2)Но если в первом случае мы возьмем убыль числа молей в единицу времени в 1 мл смеси, а во втором - в 1 л смеси, то скорости снова не будут равны! Они зависят от объема. Если проводить одну и ту же реакцию в маленькой пробирке и в большой бочке, то в пробирке прореагирует меньшее количество вещества - просто потому, что там меньше реагента.А если привести эти выражения к единице объема?v(H2) = n(H2)/VDt = Dc(H2)/Dt, v(I2) = n(I2)/VDt=Dc(I2)/D tгде Dc изменения молярных концентраций соответствующих веществ.
Тогда vH2 = vI2 = v данной реакции!Таким образом, конечное определение будет:
| Скорость химической реакции - это изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени: v = Dc/Dt [моль/литр*сек] |
Константа скорости реакции зависит в первую очередь от природы реагирующих веществ. Калий быстрее взаимодействует с водой, чем натрий, а литий - еще медленнее натрия. Водород реагирует с кислородом очень быстро (часто со взрывом), а азот с кислородом - крайне медленно и лишь в жестких условиях (электрический разряд, высокие температуры).Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа(сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
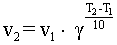
|
где g - tтемпературный коэффициент, принимающий значения от 2 до 4.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:k = koe-E/RT
где ko и E dзависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.Скорость реакции измеряют по изменению концентраций участвующих в ней веществ за определенный промежуток времени. Скоростью химической реакции называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства:
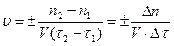 ,
,
где n1 – число молей участника реакции в момент времени t1, n2 – число молей того же вещества в момент времени t2, а t1, t2– начальный и конечный момент времени реакции.
Отношение количества вещества к единице объема – это не что иное, как молярная концентрация вещества С(В). Различают среднюю скорость реакции ( 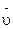 ) и истинную скорость (υ), т.е. скорость в данный момент времени.
) и истинную скорость (υ), т.е. скорость в данный момент времени.
Средняя скорость реакции 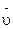 равна отношению изменения концентрации реагирующего вещества Δc(В) к промежутку времени, в течение которого оно произошло:
равна отношению изменения концентрации реагирующего вещества Δc(В) к промежутку времени, в течение которого оно произошло:
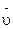 =
= 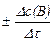 =
= 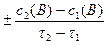 , [моль/л∙с], (1)
, [моль/л∙с], (1)
где c1(В), c2(В) – молярная концентрация вещества в момент времени t1 и t2, соответственно.
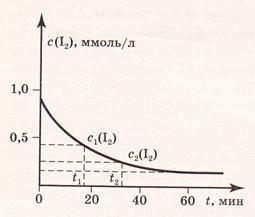
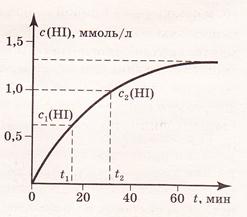
Скорость гомогенной реакции равна изменению концентрации какого-либо из участников реакции (реагента или продукта) в единицу времени.Изменение концентрации реагентов продуктов реакции во времени изображают графически (рис. 1 и 2). В начальный момент времени (t=0) концентрация реагентов наибольшая, а концентрация продуктов обычно равна нулю. В процессе реакции концентрация реагентов уменьшается, а концентрация продуктов растет. Рассмотрим на рис. 1 и 2 для реакции H2(г) + I2(г) = 2HI(г)
| 
|
| Рис. 1. Изменение концентрации реагента C(I2) в зависимости от времени t реакции. | Рис.2. Изменение концентрации продукта реакции C(НI) в зависимости от времени t реакции. |
Для гомогенной реакции A + B ® D (все стехиометрические коэффициенты равны единице):
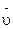 =
= 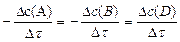 Для гомогенной реакции 2A ® 3D (нужно учесть стехиометрические коэффициенты 2 и 3):
Для гомогенной реакции 2A ® 3D (нужно учесть стехиометрические коэффициенты 2 и 3):
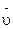 =
= 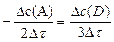 В процессе реакции при постоянных внешних условиях скорость меняется из-за расходования реагентов. И для определения кинетических закономерностей используют не среднюю, а мгновенную скорость реакции.
В процессе реакции при постоянных внешних условиях скорость меняется из-за расходования реагентов. И для определения кинетических закономерностей используют не среднюю, а мгновенную скорость реакции.
Скорость реакции мгновенная или истинная (υ) равна изменению концентрации вещества за бесконечно малый промежуток времени:
υ = ± 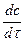 , [моль/л∙с, моль/л∙мин], (2) Поскольку скорость реакции должна быть величиной положительной, то в формулах (1) и (2) при увеличении концентрации вещества в ходе реакции (продукты реакции) ставят пред дробью знак «+», а при уменьшении концентрации вещества (исходные вещества) - знак «–», так как скорость реакции должна быть величиной положительной.
, [моль/л∙с, моль/л∙мин], (2) Поскольку скорость реакции должна быть величиной положительной, то в формулах (1) и (2) при увеличении концентрации вещества в ходе реакции (продукты реакции) ставят пред дробью знак «+», а при уменьшении концентрации вещества (исходные вещества) - знак «–», так как скорость реакции должна быть величиной положительной.

Вопрос 20
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:
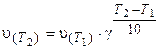 (3.6)
(3.6)
где v(T2) и v(T1) - скорости реакций, соответственно при температурах Т2 и T1 (T2> T1);
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:
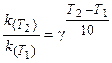 (3.7)
(3.7)
где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
γ -температурный коэффициент скорости реакции.
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем
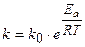 , (3.9)
, (3.9)
где k - константа скорости реакции;
k0 - предэксноненциальный множитель;
е - основание натурального логарифма;
Ea - постоянная, называемая энергией активации, определяемая природой реагентов:
R-универсальная газовая постоянная, равная 8,314 Дж/моль×К.
Значения Еa для химических реакций лежат в пределах 4 - 400 кДж/моль.
Многие реакции характеризуются определенным энергети-ческим барьером. Для его преодоления необходима энергия актации - некоторая избыточная энергия (по сравнению со вредней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового ве-щества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение (3.9) после логарифмирования примет вид:
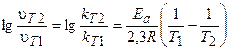 . (3.10)
. (3.10)
Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
Скорость химических реакций возрастает в присутствии катализатора. Действие катализатора заключается в том, что он образует с реагентами неустойчивые промежуточные соединения (активированные комплексы), распад которых приводит к. образованию продуктов реакции. При этом энергия активации, понижается, и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие, катализатора. В результате возрастает общее число активных£ молекул и увеличивается скорость реакции.
Изменение скорости реакции в присутствии катализатора выражается следующим уравнением:
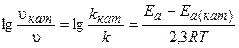 , (3.11)
, (3.11)
где vкат, и Ea(кат) - скорость и энергия активации химической реакции в присутствии катализатора;
v и Еа - скорость и энергия активации химической реакции без катализатора.
Вопрос 21
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
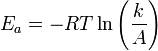 ,
,
где k — константа скорости реакции, 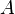 — фактор частоты для реакции,
— фактор частоты для реакции, 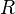 — универсальная газовая постоянная,
— универсальная газовая постоянная, 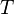 — температура в кельвинах.
— температура в кельвинах.
Активные молекулы – это молекулы, обладающие повышенным запасом энергии по сравнению со средней энергией молекул тех же веществ. Разность между запасом энергией активных молекул и средней энергией молекул этого вида в данных условиях называется энергией активации. Т.о., энергия активации Еакт. (Дж/моль) представляет собой то количество энергии, которое нужно сообщить молекуле со средней по запасу энергией, чтобы сделать эту молекулу активной для реакции.
Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз[1]. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции - десорбция[2]
Диффу́зия (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) распространение молекул или атомов одного вещества между молекулами или атомами другого, приводящее к самопроизвольному выравниванию их концентраций по всему занимаемому объёму
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряютобратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие[2].








