Не все параметры состояния независимы, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров состояния.
Энтальпия– функция состояния системы, она не зависит от пути перехода системы из одного состояния в другое. Абсолютное значение энтальпии определить невозможно, можно определить только её изменение. В термохимии изменение энтальпии называют тепловым эффектом реакции.
Энтальпия процесса 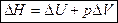
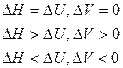
Формулировка 1-ого закона химической термодинамики:
Если к системе подводится теплота, то она расходуется на изменение внутренней энергии системы и совершение системой работы.
U – внутренняя энергия. Под внутренней энергией подразумевается общий запас энергии, включая энергию межмолекулярного взаимодействия в среде, энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов и других частиц, за исключением кинетической и потенциальной энергии системы в целом.
Внутренняя энергия системы это функция состояния вещества, её изменение не зависит от пути перехода из одного состояния в другое.
Абсолютное значение внутренней энергии определить невозможно, можно определить только её изменение(DU).
В термодинамике обычно исследуют две формы передачи энергии от одной системы к другой – теплоту и работу.
Теплота (Q) – микроскопическая форма передачи энергии при столкновении хаотически движущихся молекул и атомов соприкасающихся тел.
Под работой (А) подразумевается работа системы против внешних сил (давления, электрических и магнитных полей и др.)
В отличие от внутренней энергии, работа и теплота не являются функциями состояния системы, они зависят от вида процесса.
Если система переходит из одного состояния характеризуемого объёма V1 в другое, с объёмом V2 то:
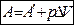 , где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
, где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
Если изучаемая система находится только под действием давления, то A = рDV, тогда 1-ый закон термодинамики имеет вид: 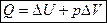 .
.
1) Для изохорных процессов (V=const, ΔV=0):
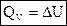 , т. е. теплота расходуется только на изменение внутренней энергии.
, т. е. теплота расходуется только на изменение внутренней энергии.
2) При постоянном давлении (изобарные процессы):
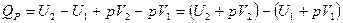
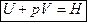 , где Н – энтальпия (теплосодержание системы), т. е.
, где Н – энтальпия (теплосодержание системы), т. е.
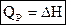
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
· Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давленииQp(изобарный процесс).
· В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образовани
ноября 2014; проверки требует 1 правка.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
· Тепловой эффект химической реакции , проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
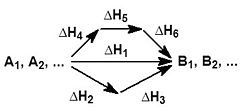
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Вопрос 17
Второй закон термодинамики, как и первый, является постулатом, обоснованным многовековым опытом человечества. Открытию этого закона способствовало изучение тепловых машин. Французский ученый С. Карно первым показал (1824 г.), что любая тепловая машина должна содержать помимо источника теплоты (нагревателя) и рабочего тела (пар, идеальный газ и др.), совершающего термодинамический цикл, также и холодильник, имеющий температуру обязательно более низкую, чем температура нагревателя.
Коэффициент полезного действия η такой тепловой машины, работающей по обратимому циклу (циклу Карно), не зависит от природы рабочего тела, совершающего этот цикл, а определяется только температурами нагревателя Т1 и холодильника Т2:
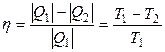 , (3.1)
, (3.1)
где Q1 – количество теплоты, сообщенное рабочему телу при температуре Т1 от нагревателя; Q2 – количество теплоты, отданное рабочим телом при температуре Т2 холодильнику.
Второй закон термодинамики представляет собой обобщение вывода Карно на произвольные термодинамические процессы, протекающие в природе. Известно несколько формулировок этого закона.








