2. Число полученных молекулярных орбиталей равно числу исходных атомных.
3. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называетсясвязывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называетсяразрыхляющей.
4. При перекрывании атомных орбиталей возможно образование и -связи (перекрывание по оси химической связи), и -связи (перекрывание по обе стороны от оси химической связи).
5. Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
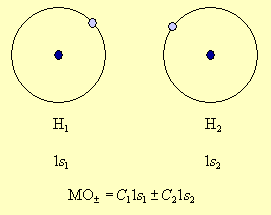
|
Вопрос 15
Ионная связь — химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эту способность можно оценить энергией ионизации и сродством атомов к электрону. Легче всего образуют катионы щелочные и щелочно-земельные металлы.
Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
Анион — отрицательно заряженный ион. Характеризуется величиной отрицательного заряда; например, Cl− — однозарядный анион, а SO42− — двухзарядный анион. В электрическом поле анионы перемещаются к положительному электроду — аноду. Анионы имеются в растворах большинства солей, кислот и оснований, а также в кристаллических решетках соединений с ионной связью и в расплавах.
Катион — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4+ — однозарядный катион, Ca2+ — двухзарядный катион.
Переход имплантационной технологии из лабораторий в промышленность ввел в действие мощный экономический фактор оценки - производительность и стоимость операции. Особенно остро этот вопрос встал именно в связи с “имплантационной металлургией” или имплантацией больших доз, где решающим фактором стоимости всей технологии становится производительность имплантационного оборудования. Даже в полупроводниковой технологии, где размеры обрабатываемой поверхности незначительны, длительность и стоимость операции легирования эмиттерных слоев на стандартном имплантационном оборудовании оказалась непомерно высокой; для потребностей же машиностроения эта проблема усугубляется и масштабом производства, и дешевизной остальных операций технологической цепочки.
Вопрос 16
Термодинамическая система — совокупность макроскопических тел, которые могут взаимодействовать между собой и с др. телами (внешней средой) — обмениваться с ними энергией ивеществом; состоит из столь большого числа структурных частиц (атомов, молекул), что её состояние можно характеризовать макроскопическими параметрами: плотностью, давлением, концентрацией веществ, образующих термодинамическую систему, и т.д. Термодинамическая система находится вравновесии, если параметры системы с течением времени не меняются и в системе нет каких-либо стационарных потоков (теплоты, вещества и др.). Для равновесных термодинамических системвводится понятие температуры как параметра состояния, имеющего одинаковое значение для всех макроскопических частей системы. Число независимых параметров состояния равно числу степеней свободы термодинамической системы, остальные параметры могут быть выражены через независимые с помощью уравнения состояния. Свойства равновесных термодинамических системизучает термодинамика равновесных процессов (термостатика); свойства неравновесных систем —термодинамика неравновесных процессов. Рассматривают термодинамические системы:
§ закрытые, не обменивающиеся веществом с др. системами;
§ открытые, обменивающиеся веществом и энергией с др. системами;
§ адиабатные, в которых отсутствует теплообмен с др. системами;
§ изолированные, не обменивающиеся с др. системами ни энергией, ни веществом.
Если термодинамическая система не изолирована, то её состояние может изменяться: изменение состояния термодинамическая системы называют термодинамическим процессом.
Термодинамическая система может быть физически однородной (гомогенной системой) и неоднородной (гетерогенной системой), состоящей из нескольких однородных частей с разными физическими свойствами. В результате фазовых и химических превращений гомогенная термодинамическая система может стать гетерогенной и наоборот.
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём,намагниченность, электрическая поляризация и др. Различают экстенсивные параметры состояния, пропорциональные массе системы:
§ объём,
§ внутренняя энергия,
§ энтропия,
§ энтальпия,
§ энергия Гиббса,
§ энергия Гельмгольца (свободная энергия),
и интенсивные параметры состояния, не зависящие от массы системы:
§ давление,
§ температура,
§ концентрация,
§ магнитная индукция и др.








