Масса и размеры атомов и молекул.
Вопрос 1
Хи́мия — наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций
Как одна из отраслей естествознания, химия связана с другими естественными науками. Химические изменения всегда сопровождаются изменениями физическими. Широкое применение физических методов исследования и математического аппарата в химии сблизило её с физикой и математикой. Химия также связана и с биологией, поскольку биологические процессы сопровождаются непрерывными химическими превращениями. Химические методы используют для решения проблем геологии. Связь между различными естественными науками очень тесная, на стыках наук возникают новые науки, например, ядерная химия, биохимия, геохимия, космохимия и т.д.Изучение химическими методами ряда технических проблем связывает химию с инженерно – техническими и специальными дисциплинами, необходимыми для практической деятельности инженера. Так, производство стали и других сплавов, чистых металлов и полупроводников, выработка из них изделий и их дальнейшее использование, эксплуатация различных механизмов в соответствующих газовых и жидких средах – всё это требует конкретных химических знаний и умения применить их на практике.Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам лишь исходное сырьё – дерево, руду, нефть, газ и др. Подвергая природные материалы химической переработке, получают разнообразные вещества, необходимые для сельского хозяйства, промышленности, домашнего обихода – удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т.д. Химия нужна человечеству для того, чтобы получить из веществ природы, по возможности, всё необходимое – металлы, цемент и бетон, керамику, фарфор и стекло, каучук, пластмассы, искусственные волокна, фармацевтические средства. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания даёт химия.
Вопрос 2
В основе физики и химии лежит атомно-молекулярное учение. Источником для зарождения атомно-молекулярного учения являются труды древнегреческих философов, основным научным методом которых являлись дискуссия, спор. Для поиска первопричин в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет, если начать его дробить? Большинство философов считало, что этот процесс можно продолжать бесконечно, и только Левкипп утверждал, что этот процесс не бесконечен: при дроблении, в конце концов, получится такая частица, дальнейшее деление которой будет просто невозможно. Основываясь на этой концепции, Левкипп (500–440 гг. до н.э.) утверждал: "Материальный мир дискретен, он состоит из мельчайших частиц и пустоты".Ученик Левкиппа Демокрит (460–370 гг. до н.э.) назвал мельчайшие частицы, из которых состоит вещество, "неделимые", что в переводе на греческий значит "атомы". Демокрит, развивая новое учение – атомистику, приписал атомам такие современные свойства, как размер и форму, способность к движению.Последователь Демокрита Эпикур (342–270 гг. до н.э.) придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.Хотя атомистика древних греков и выглядит удивительно современно, ни одно из ее положений не было доказано. Об учении атомистов не вспоминали почти 20 веков. И только в середине XVIII в. учение было возрождено, развито и впервые применено в химии великим русским ученым М.В. Ломоносовым. Основные положения учения были изложены впервые в 1741 г. в работе "Элементы математической химии".Несколько позднее атомистическое учение в химии было применено и развито Дальтоном ("Новая система химической философии", 1808 г.).Настоящая наука отличается от произвольных наблюдений и случайных опытов тем, что научный результат всегда воспроизводим. Если ученый сообщил, в каких условиях воздействие на системы вызывает определенный результат, можно получить тот же результат, поставив другой опыт при тех же условиях.Для химических экспериментов особое значение имеет соблюдение определенного температурного режима, чистоты исходных веществ, концентраций и порядка проведения реакции. При этом обычно предполагается, что объект иссследования находится в той же инерционной системе (т. е. движется в пространстве с той же постоянной скоростью).При проведении опытов химики используют основной закон природы — закон сохранения массы веществ: сумма масс исходных соединений равна сумме масс продуктов химической реакции. Первая общая формулировка этого закона была дана М. В. Ломоносовым в 1748—1760 гг.: «Все перемены, в натуре встречающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Сей всеобщий естественный закон простирается и в самые правила движения». В 1840 г. того же века французский химик А. Лавуазье на основе многочисленных экспериментов доказал закон сохранения массы. А в 1840 г. основатель термохимии профессор Петербургского горного института Г. И. Гесс сформулировалзакон сохранения энергии для химических реакций: «Тепловой эффект любой химической реакции зависит лишь от начального и конечного состояния системы и не зависит от промежуточных состояний и путей перехода».Но можно ли применять эти законы, если реакция идет не в инерционных условиях? Например, как учесть соотношение масс и энергий космической ракеты, летящей в иную галактику, и газов, вылетающих из сопел ее двигателей (или фотонов, мезонов и т. д.)? В этом случае придется пользоваться более общим выражением закона сохранения массы веществ и энергии по уравнению А. Эйнштейна:
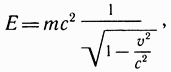
где Е — энергия тела,  — его масса, v — скорость движения, с — скорость света в вакууме, равная 300 000 км/с.
— его масса, v — скорость движения, с — скорость света в вакууме, равная 300 000 км/с.
В земных условиях (особенно при проведении химических реакций при нормальных температуре и давлении) изменение массы настолько ничтожно, что мы его просто-напросто не можем обнаружить. Поэтому в лабораторной и производственной практике на каждом шагу пользуются законом сохранения массы веществ в его классической форме.Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
Вопрос 3
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.Из Закона Авогадро выводится 2 следствия:
Следствие 1 : Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
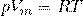
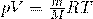
Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона
1) Закон Шарля : 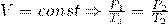
2) Закон Гей-Люссака : 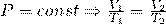
3) Закон Боля-Мариотта : 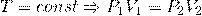
Следствие 2 : Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
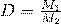 В Формуле мы использовали :
В Формуле мы использовали :
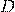 — Относительная плотность газа
— Относительная плотность газа
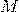 — Молярные массы
— Молярные массы
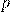 — Давление
— Давление
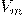 — Молярный объем
— Молярный объем
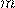 — Масса
— Масса
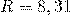 — Универсальная газовая постоянная
— Универсальная газовая постоянная
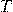 — Абсолютная температу
— Абсолютная температу
Существование микрочастиц - молекул , атомов и ионов подтверждается непосредственным наблюдением в электронных микроскопах, растворимостью твердых тел в жидкостях, механическим дроблением твердых тел, сжимаемостью и проницаемостью веществ.
Непрерывность движения микрочастиц подтверждается диффузией , броуновским движением , способностью газов неограниченно расширятся и занимать весь предоставленный объем.
О взаимодействии микрочастиц позволяют утверждать прочность и упругость веществ, способность жидкостей смачивать некоторые твердые тела, поверхностное натяжение жидкостей и др.
Масса и размеры атомов и молекул.
Молярная масса - физическая величина, равная отношению массы вещества к количеству вещества.
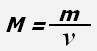 где M - молярная масса, m - масса вещества, ν - количество вещества.
где M - молярная масса, m - масса вещества, ν - количество вещества.
Молярная масса численно равна массе одного моля вещества.
Единица измерения молярной массы - кг/моль.
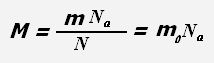
где Na = 6,022·1023 моль-1 - постоянная Авогадро,
N - число частиц системы, m 0 - масса одной молекулы (для веществ атомарного строения - масса атома).
Масса молекулы равна отношению массы всего вещества к количеству молекул в веществе или отношению молярной массы к постоянной Авогадро.
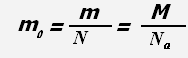
Единица измерения массы молекулы - кг.
Средняя масса молекул 10-23 - 10 -26 кг. Например, масса молекулы воды - 3·10-26 кг.
Размер атома определяется расстоянием от центра ядра до орбит, на которых находятся валентные электроны или расстоянием от центра ядра до внешних заполненных электронных орбит.
Размер молекул - условная величина.
Эффективным диаметром молекулы называют расстояние предельного сближения центров двух молекул. Размеры молекулы порядка 10 -10 м. Например, эффективный диаметр молекулы воды примерно 4·10 -26 м.
Для молекул (атомов) веществ в твердом и жидком состоянии примерный объем одной молекулы (атома) равен отношению всего объема вещества к количеству молекул (атомов).
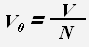
где V 0 -объем молекулы или атома
Относительной атомной массой является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы.
Ar = mат. / (1/12)mугл.
Для молекул используется понятие относительной молекулярной массы (Mr). Относительная молекулярная масса показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода.
Число авогадро - это величина указывающая, сколько в моле различных веществ - находится молекул , а так же содержание атомов в простых веществах. Является одним из основных постоянных, при его помощи определяется масса атома, заряд электрона или масса молекулы 6,02214129(27)·10²³ моль
Вопрос 4
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, лорпрарит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).Количество вещества - это физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого вещества.Единица количества вещества - моль - отвечает такому количеству вещества, которое содержит 6,02 · 1023 частиц этого вещества (число Авогадро). Если числу Авогадро приписать единицу измерения моль−1, то получится физическая константа - постоянная Авогадро (обозначение NА):
NА = 6,02 · 1023 моль−1
Молярная массаКоличество вещества 1 моль, то есть порция, обязательно содержащая 6,02. 1023 частиц, обладает определенной массой, характерной для данного вещества - молярной массой (обозначение М).Молярную массу вещества В можно определить как отношение массы данной порции вещества mВ к количеству вещества nВ в этой порции:
МВ = mB/nBЕдиница измерения молярной массы: г/моль.
Молярный объем газаМоля́рный объём — объём одного моль вещества, величина, получающаяся от деления молярной массы наплотность. Характеризует плотность упаковки молекул.
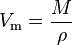 Из равенства количества вещества:
Из равенства количества вещества: 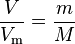 используя
используя 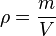 , приходим к:
, приходим к: 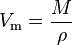
Значение NA = 6,022…×1023 называется постоянной Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моль железа (Fe), молекул в 1 моль воды H2O и т. д.Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объёмVm = 22,413968(20) л/моль[1]. При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратное.
Вопрос 5
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементовМенделеева.Простые вещества — вещества, состоящие исключительно из атомов одногохимического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ.В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar)газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование двух и болеепростых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных модификаций или форм.Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы)
| Элемент | Аллотропные модификации |
| Водород: | Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны. |
| Углерод: | Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки,лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структурыфуллеренов и нанотрубок. |
| Фосфор: | Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. |
| Кислород: | Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден. |
| Сера: | Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера. |
| Селен: | Красный цикло-Se8, серый полимер Se и чёрный селен. |
Полуметаллы[править | править вики-текст]
| Элемент | Аллотропные модификации |
| Бор: | Бор существует в аморфном и кристаллическом видах. Аморфный бор — порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор — вещество чёрного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация — β-ромбический бор — состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру. |
| Кремний: | Различают две основные аллотропные модификации кремния — аморфную и кристаллическую. Решётка кристаллической модификации кремния — атомная, алмазоподобная. Также выделяют поликристаллический и монокристаллический кремний. |
| Мышьяк: | Три основные аллотропные модификации: жёлтый мышьяк (неметалл, состоящий из молекул As4 — структура, аналогичная белому фосфору), серый мышьяк (полуметаллический полимер), чёрный мышьяк (неметаллическая молекулярная структура, аналогичная красному фосфору). |
| Германий: | Две аллотропные модификации: α-Ge — полуметалл с алмазоподобной кристаллической решёткой и β-Ge — с металлической структурой, аналогичной β-Sn. |
| Сурьма: | Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком |
| Полоний: | Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них — низкотемпературной — имеют кубическую решетку (α-Po), а другой — высокотемпературной — ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением. |
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.
Вопрос 6
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при которых ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.Классификация по числу и составу реагентов и конечных веществ1. Реакции соединенияПри реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава :A + B + C = D Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:А = В + С + D. Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества .Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| to | ||
| CuSO4 5H2O | = | CuSO4 + 5H2O |
| to | ||
| Cu(OH)2 | = | CuO + H2O |
| to | ||
| H2SiO3 | = | SiO2 + H2O. |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
| to | ||
| 2SO3 | = | 2SO2 + O2. |
| to | ||
| 4HNO3 | = | 2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.Реакции разложения в органической химии носят название крекинга:С18H38 = С9H18 + С9H20,
или дегидрирования
C4H10 = C4H6 + 2H2.3. Реакции замещенияПри реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:А + ВС = АВ + С.Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2,Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,Иногда эти реакции рассматривают как реакции обмена:СН4 + Сl2 = СН3Сl + НСl.
4. Реакции обменаРеакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:АВ + СD = АD + СВ.Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:ZnO + Н2SО4 = ZnSО4 + Н2О,AgNО3 + КВr = АgВr + КNО3,СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.Частный случай этих реакций обмена - реакции нейтрализации:НСl + КОН = КСl + Н2О.Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
5. Реакции переноса.При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:АВ + ВС = А + В2С,А2В + 2СВ2 = АСВ2 +АСВ3.Например:2AgCl + SnCl2 = 2Ag + SnCl4,H2O + 2NO2 = HNO2 + HNO3.Современное промышленное производство основных химических материалов, как неорганических, так и органических, осуществляется методами химического синтеза. В качестве исходных материалов для осуществления промышленного синтеза в настоящее время широко используются природные газы, например газы атмосферы – азот и кислород, а также залегающие в пластах горючие газы, главной составной частью которых является метан. Кроме того, в качестве исходных веществ для химических производств приобрели очень большое значение газы, получаемые попутно при добыче или первичной обработке полезных ископаемых, например коксовый газ, продукты газификации топлива, бедные сернистые газы, попутные нефтяные газы.Наряду с изысканием и освоением новых видов массового сырья для химических производств постоянно разрабатываются новые и совершенствуются уже известные технологические процессы в направлении роста выходы продукции, улучшения ее качества и, что очень важно, обеспечения охраны окружающей среды.Современная техника нуждается в некоторых материалах в исключительно чистом состоянии. Такие материалы необходимы, например, в качестве полупроводников, а также для использования в ядерной технике и для других целей. В связи с этим перед химией встала задача разработать методы сверхтонкой очистки некоторых веществ, а также методы оценки степени очистки. В настоящее время промышленностью освоено производство некоторых сверхчистых материалов с содержанием примесей не выше миллионных долей процента.В современной технике наряду с широким применением металлов в качестве конструкционных, инструментальных и других материалов используются и неметаллические вещества, как простые (графит, алмаз), так и сложные (оксиды, нитриды, карбиды, полимеры).
Вопрос 7
Корпускулярно-волновой дуализм свойств вещества.
Французский ученый Луи де Бройль (родился в 1892), развивая представления о двойственной корпускулярно-волновой природе света, выдвинул в 1924 г. гипотезу об универсальности корпускулярно-волнового дуализма. Де Бройль утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Итак, согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики энергия Е и импульс р, а с другой — волновые характеристики — частота 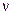 и длина волны
и длина волны 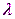 . Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
. Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
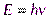 ,
, 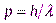 . (1.1)
. (1.1)
Гипотеза де Бройля.
Смелость гипотезы де Бройля заключалась именно в том, что соотношение (1.1) постулировалось не только для фотонов, но и для других микрочастиц, в частности для таких, которые обладают массой покоя. Таким образом, любой частице, обладающей импульсом, поставляют волну, длина которой вычисляется по формуле де Бройля:
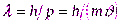 (2.1)
(2.1)
где 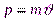 - импульс частицы, имеющей массу т и движущейся со скоростью
- импульс частицы, имеющей массу т и движущейся со скоростью 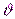 .
.
Вскоре гипотеза де Бройля была подтверждена экспериментально. В 192 7 г. американские физики К. Дэвиссон (1881 - 1958) и Л. Джермер (1896 -1971) обнаружили, что пучок электронов, рассеивающийся от естественной дифракционной решетки - кристалла никеля, - дает отчетливую дифракционную картину. Дифракционные максимумы соответствовали формуле Вульфа - Брэггов ( 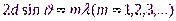 ), а брэгговская длина волны оказалась в точности равной длине волны, вычисленной по формуле (2.1). В дальнейшем формула де Бройля была подтверждена опытами П. С. Тартаковского и Г. Томсона, наблюдавших ,дифракционную картину при прохождении пучка быстрых электронов (энергия
), а брэгговская длина волны оказалась в точности равной длине волны, вычисленной по формуле (2.1). В дальнейшем формула де Бройля была подтверждена опытами П. С. Тартаковского и Г. Томсона, наблюдавших ,дифракционную картину при прохождении пучка быстрых электронов (энергия  50 кэВ) через металлическую фольгу (толщиной
50 кэВ) через металлическую фольгу (толщиной  1 мкм).В квантовой механике принцип неопределённости Гейзенбе́рга (или Га́йзенберга) устанавливает, что существует ненулевой предел для произведения дисперсий сопряжённых пар физических величин, характеризующих состояние системы. Принцип неопределённости обнаруживается также в классической теории измерений физических величин.
1 мкм).В квантовой механике принцип неопределённости Гейзенбе́рга (или Га́йзенберга) устанавливает, что существует ненулевой предел для произведения дисперсий сопряжённых пар физических величин, характеризующих состояние системы. Принцип неопределённости обнаруживается также в классической теории измерений физических величин.
Обычно принцип неопределённости иллюстрируется следующим образом. Рассмотрим ансамбль невзаимодействующих эквивалентных частиц, приготовленных в определённом состоянии, для каждой из которых измеряется либо координата q, либо импульс p. При этом результаты измерений будут случайными величинами, среднеквадратические отклонения которых от средних значений будут удовлетворять соотношению неопределённостей 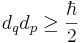 , где
, где 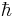 – постоянная Дирака. Поскольку любое измерение изменяет состояние каждой частицы, при одном измерении нельзя одновременно измерить значения и координаты и импульса. Для ансамбля частиц уменьшение дисперсии при измерении физической величины приводит к увеличению дисперсии сопряжённой физической величины. Считается, что принцип неопределённости связан не только с возможностями экспериментальной техники, но и показывает фундаментальное свойство природы.
– постоянная Дирака. Поскольку любое измерение изменяет состояние каждой частицы, при одном измерении нельзя одновременно измерить значения и координаты и импульса. Для ансамбля частиц уменьшение дисперсии при измерении физической величины приводит к увеличению дисперсии сопряжённой физической величины. Считается, что принцип неопределённости связан не только с возможностями экспериментальной техники, но и показывает фундаментальное свойство природы.
Уравнение Шредингера в общем виде записывается так:
| (4.4.1) |

Вопрос 8
Электронное облако — модель состояния электрона в атоме. Плотность участков облака пропорциональна вероятности нахождения там электрона. Электронное облако часто изображают в виде граничной поверхности (охватывающей примерно 90 % электронного облака).
Вопрос 9
11. Химия s -элементовПоложение s -элементов в периодической системе. Особенности электронных структур ns 1 и ns 2 -элементов. Валентность и степень окисления. Нахождение в природе.
Строение атома водорода и его положение в периодической системе. Изотопы водорода. Нахождение в природе. Физические и химические свойства водорода. Применение водорода. Водородная энергетика.
Сравнительная характеристика физических и химических свойств простых элементов.
Сравнительная характеристика важнейших соединений s -элементов (оксидов, гидридов, гидроксидов, пероксидов, солей). Особенности химии бериллия и лития.
Биологические функции магния, кальция, натрия и калия. Калий как один из основных элементов питания растений.
Жесткость воды и способы ее устранения.
Правила хранения и техника безопасности при работе со щелочными и щелочно-земельными металлами.
12. Химия р-элементов
Положение в периодической системе. Особенность электронных структур атомов р-элементов. Изменение радиуса, энергии ионизации, энергии сродства к электрону, электроотрицательности по периодам и группам с ростом заряда ядра. Валентность и степень окисления атомов. Правило четности.
Простые вещества. Типы кристаллических решеток. Аллотропия. Физические и химические свойства. Специфические и индивидуальные свойства отдельных элементов.
Водородные соединения р-элементов. Обзор изменения характера связей, физических и химических свойств соединений по периодам (на примере 2-го и 3-го периодов) и группам (5А, 6А, 7А).
Оксиды и гидроксиды р-элементов. Зависимость их кислотно-основных и окислительно-восстановительных свойств от положения атома элемента в периодической системе.
Кислород. Значение кислорода в жизни растений и животных. Озон, его свойства, образование в природе. Воздух. Постоянные и переменные части воздуха. Проблема чистого воздуха. Законы об охране атмосферного воздуха.
Сера. Распространение в природе. Аллотропия серы, физические свойства различных модификаций. Сероводород, его получение, физические и химические свойства, физиологическое действие. Сероводородная кислота, сульфиды и их свойства. Сульфиды в природе. Оксиды серы. Строение, получение, физические и химические свойства. Кислородсодержащие кислоты серы. Физические и химические свойства. Правила обращения с концентрированной серной кислотой. Производство серной кислоты и охрана окружающей среды. Сульфаты: нахождение в природе, свойства и применение. Значение серной кислоты и ее солей. Биологическая роль и круговорот серы в природе.
Азот. Азот в природе. Получение и применение азота. Аммиак; строение его молекулы, получение аммиака. Соли аммония, их структура, свойства и значение. Оксиды азота. Азотистая кислота и нитриты. Азотная кислота. Получение и свойства азотной кислоты. Техника безопасности при работе с азотной кислотой. Нитраты, их химические свойства, термическое разложение. Применение азотной кислоты и нитратов. Биологическая роль и круговорот азота в природе. Роль микроорганизмов в этом процессе. Проблема фиксации атмосферного азота. Азотные удобрения. Проблема, связанная с перенасыщением почвы и сельскохозяйственной продукции нитратами.
Фосфор. Важнейшие природные соединения. Получение фосфора. Аллотропные модификации фосфора. Правила обращения с белым фосфором. Фосфин, его образование в биохимических процессах. Оксиды фосфора. Фосфорные кислоты. Сравнительная характеристика устойчивости, кислотных и окислительно-восстановительных свойств. Применение фосфора и его соединений, роль в живых организмах. Круговорот фосфора в природе. Фосфорные удобрения и их использование при различном рН почв.
Углерод. Углерод в природе. Аллотропические видоизменения углерода, их структура, физические свойства, практическое значение. Адсорбционные свойства активированного угля. Химические свойства углерода, его практическое применение в качестве восстановителя. Водородные соединения углерода. Кислородные соединения углерода. Оксид углерода ( II ), его строение и свойства. Физиологическое действие оксида углерода ( II ) и правила техники безопасности при работе с ним. Первая помощь при отравлении угарным газом. Оксид углерода ( IV ), строение его молекулы, физические и химические свойства, получение и применение. углекислый газ в природе и его значение в фотосинтезе. Проблема парникового эффекта. Угольная кислота и ее соли. Значение карбонатов в природе и народном хозяйстве. Карбонатная буферная система. Круговорот углерода в природе.
Хлор. Распространение в природе, способы получения, физические и химические свойства хлора. Хлороводород, соляная кислота: получение, физические и химические свойства, применение. Кислородсодержащие кислоты хлора. Сравнение силы, прочности и окислительных свойств. Хлорноватистая кислота, гипохлориты и их применение. Хлорная известь. Бертолетова соль. Физиологическое действие хлора и его соединений. Охрана окружающей среды от загрязнений хлором. Физиологическое действие и биологическая роль фтора, брома, йода и их соединений.
13. Химия d -элементов
Положение d -элементов в периодической системе. Особенности электронных конфигураций и диапазон степеней окисления атомов переходных металлов. Горизонтальная аналогия. Специфика изменения свойств переходных элементов и их соединений с увеличением зарядов ядер атомов в пределах периодов и побочных подгрупп. Отличия в свойствах элементов главных и побочных подгрупп, их объяснение с позиций строения атомов.
Общая характеристика простых веществ. Нахождение в природе, физические и химические свойства, получение. Применение металлов и их сплавов.
Оксиды и гидроксиды переходных металлов. Зависимость кислотно-основных и окислительно-восстановительных свойств оксидов и гидроксидов от степени окисления атомов (на примере соединений хрома, марганца).
Комплексные соединения d -элементов. Важнейшие комплексообразователи. Природные комплексы d -элементов. Физиологическое действие соединений меди, цинка, кадмия, ртути. Биологические функции железа, кобальта, никеля. Бактерицидное действие серебра. Микроэлементы питания растений.
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.
Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень -2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
1. Принцип минимальной энергии (принцип устойчивости). Орбитали заполняются, начиная с имеющих самую низкую энергию, в порядке её повышения. Такое состояние называется основным. В этом случае энергия атома является минимальной, а устойчивость — максимальной.
Как выяснилось, в повышении энергии АО имеется закономерность, которая определяется с помощью правила Клечковского: ниже по энергии находится та орбиталь, для которой сумма значений главного и орбитального квантовых чисел (n+l) минимальна. Например, орбиталь 4s, для которой n+l = 4+0 = 4, заполняется раньше, чем 3d, где сумма n+l = 3+2 = 5. При равенстве сумм ниже по энергии находится орбиталь с меньшим значением главного кантового числа. Так, орбиталь 3d имеет более низкую энергию, чем4р.
Обычный порядок заполнения атомных орбиталей имеет следующий вид:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f =5d < 6p < 7s < 5f=6d …
2. Принцип Паули. Согласно этому принципу (запрету), в атоме не может быть двух электронов с одинаковыми наборами значений квантовых чисел n, l, ml, ms. На любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют антипараллельные спины.
3. Правило Хунда (Гунда). В каждом квантовом слое одноимённые орбитали (орбитали одного подуровня) вначале заполняются однократно электронами с параллельными спинами, с тем, чтобы суммарный спин атома был максимальным; лишь после этого начинается спаривание электронов.
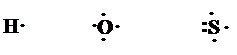 Эти три правила характеризуют электронную конфигурацию атомов различных элементов в основном состоянии. Электроны внешнего энергетического уровня иногда называют валентными электронами. Г.Н.Льюис предложил изображать валентные электроны с помощью точек, которые ставятся рядом с химическим знаком элемента:
Эти три правила характеризуют электронную конфигурацию атомов различных элементов в основном состоянии. Электроны внешнего энергетического уровня иногда называют валентными электронами. Г.Н.Льюис предложил изображать валентные электроны с помощью точек, которые ставятся рядом с химическим знаком элемента:
Такие обозначения получили название символов Льюиса.
Любая атомная орбиталь, в том числе и валентная, может иметь только три состояния:
- орбиталь не занята электронами — свободная или вакантная орбиталь;
- орбиталь занята одним электроном (неспаренный электрон), спин не компенсирован;
- орбиталь занята парой электронов с компенсированными спинами (неподелённой электронной парой).
Приведённые выше изображения атомных орбиталей (рис. 1-5) и соответствующие им наборы квантовых чисел справедливы, независимо от того, имеется ли на них неспаренный электрон, неподелённая электронная пара или не содержится ни одного электрона.
Если атом в пределах одного квантового слоя имеет неподелённую электронную пару и свободную орбиталь, он может переходить в возбуждённое состояние, переводя один электрон на следующий подуровень с изменением спина. У химического знака атома в возбуждённом состоянии ставится звёздочка (*), например, С
Если у атома водорода энергия электрона зависит от того, в каком электронном слое находится электрон (т.е. от значения главного квантового числа - n), то в многоэлектронном атоме в момент заполнения электронной оболочки энергия электрона тем меньше, чем меньше сумма n+l (главного и орбитального квантовых чисел). При их равенстве, например у орбиталей 3d (3+2=5) и 4p (4+1=5), меньшей энергией будет обладать электрон, у которого меньше n - этоПравило Клечковского.
Электронно-графическая формула
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях. В такой формуле все электроны помечаются стрелочками, а квадратиками – орбитали. Для того чтобы составить электронно-графическую формулу, необходимо понять строение самого атома, а особенно его ядра. В состав ядра атома входят нейтроны и протоны. Вокруг ядра вращаются на электронных орбиталях электроны.
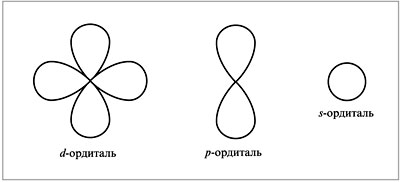
Существуют такие уровни электронно-графической формулы:
s-элементы. Записывается таким образом s1 — s2 - s-подуровень внешнего уровня. Здесь расположены всегда первые два элемента из каждого периода: Ве 1S2 2S2.
р-элементы. Записывается таким образом р1 -- p6. р - подуровень внешнего уровня. Здесь расположены всегда шесть последних элемента каждого, начиная со второго,периода: Na 1s 22s 22p 63s 1.
d-элементы Записывается таким образом d1 — d10. d-подуровень последнего уровня. Данные элементы отличаются от первых двух, так как на внешнем уровне может оставаться 1 или 2 электрона. Сюда принадлежат элементы вставных декад, начиная с четвертого периода, которые расположенные между p и s-элементами. Они могут называться, как переходные элементы: Zr 1s22s 22p 63s 23p64s 23d104p65s24d2.
f-элементы Записывается таким образом f1 —f14, внешнее строение электронного уровня не поддается изменениям. Сюда относят актиноиды и лантаноиды, которые стоят в седьмом и шестом периодах: Ce 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2.
Исходя из вышесказанного, формулы создаются в соответствии с максимально возможным числом электронов, что находятся на энергетических уровнях: первый уровень включает два электрона, второй — восемь, третий — восемнадцать, а четвертый — тридцать два.
От заполнения ячеек электронами энергетических уровней зависит деление групп на побочную и главную подгруппы. Таким образом, главную подгруппу образуют s- и p-элементы, а d-элементы - побочную подгруппу. В каждой из этих групп элементы, имеющие похожее строение внешнего энергетического уровня объединяются в атомы. Атомы главных подгрупп имеют на внешних уровнях число электронов, которое равняется номеру группы, это валентные электроны. В побочных группах валентные еще и электроны предпоследних уровней. Отсюда можно сделать вывод, что нумерация групп указывает, как правило, на количество электронов, участвующих в образовании связей.
Вопрос 10
Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».[
При переходе от одного элемента к следующему в периодической системе электрон стремится занять состояние с минимальной энергией. Последовательность заполнения электронами энергетических уровней и подуровней в порядке возрастания их энергии подчиняется правилу М. В. Клечковского и имеет
следующий вид:
1s < 2s < 2p < зs < Зp < 4s < 3d< 4р < 5s < 4d< 5р < 6s < 5d (или 4f ) <6p
Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
Энергия ионизации Еi — это энергия, необходимая для отрыва наиболее
слабо связанного электрона от атома, количественно выражается в кДж/моль
или эВ. Чем меньше энергия ионизации, тем легче атом отдает электрон при
образовании химической связи, т.е. элемент является более сильным восстановителем. Поэтому восстановительная способность нейтральных атомов с ростом заряда ядра в периоде уменьшается, а в главных подгруппах растет.
Энергия сродства к электрону Еср — энергия, выделяющаяся при присоединении электрона к нейтральному атому, количественно выражается в кДж/моль или эВ. Она определяет окислительные свойства несвязанных атомов. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2, s2p6. У остальных элементов в таблице Д.И. Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Характеристика элемента по его положению
в Периодической системе Д. И. Менделеева
с точки зрения строения атома
(на примере Mg)
Магний имеет порядковый номер Z = 12, следовательно, заряд ядра его атома +12. Элемент магний находится в третьем малом периоде, значит, его 12 электронов располагаются по трем энергетическим уровням. Магний находится во второй группе главной подгруппе, следовательно, на внешнем энергетическом уровне атома содержатся 2 электрона.
Относительная атомная масса магния Ar = 24. В ядре атома магния содержатся 12 протонов, так как заряд ядра +12. Кроме протонов в ядре содержатся 24 – 12 = 12 нейтронов. Так как атом электронейтрален, то вокруг ядра атома магния вращаются 12 электронов, которые располагаются по энергетическим уровням и подуровням следующим образом:
1s2 2s2 2p6 3s2
валентные
электроны
Магний — это типичный металл, так как он находится в начале периода. У магния металлические свойства выражены ярче, чем у алюминия, но слабее, чем у натрия, так как в периоде с возрастанием заряда ядра металлические свойства ослабевают, а неметаллические усиливаются. У магния металлические свойства выражены ярче, чем у бериллия, но слабее, чем у кальция, так как в группе в главной подгруппе с возрастанием заряда ядра металлические свойства усиливаются, а неметаллические — ослабевают.
Соединения магния (оксид и гидроксид) носят основный характер.
Оксид магния — MgO.
Гидроксид магния — Mg(OH)2.
Водородное соединение — MgH2 (гидрид магния).
Магний проявляет в соединениях валентность II.
Историческая справка
Вопрос 11
Энергия связи – это энергия, необходимая для разрыва химической связи. Энергии разрыва и образовании связи равны по величине, но противоположны по знаку. Чем больше энергия химической связи, тем устойчивее молекула. Обычно энергию связи измеряют в кДж/моль. Например, на разрыв связи H–H затрачивается 432,1 кДж/моль энергии.
Для многоатомных соединений с однотипными связями за энергию связи
принимается среднее ее значение, рассчитанное делением суммарной энергии данных связей на число связей. Так, на разрыв четырех связей в молекуле метана CH4 – 1648 кДж/∙моль и в этом случае EC–H = 1648 : 4 = 412 кДж/моль.
Длина связи – это расстоянию между ядрами взаимодействующих атомов в соединении. Измеряется в нанометрах (10–9м). Иногда применяется Å (ангстрем = 10–8 см).
Направленность – определенное направление химической связи, которое возникает в результате перекрывания электронных облаков. Направленность определяется строением молекулы
Ионная связь.Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2, F2, Cl2, O2, N2. Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодей-ствием, которые осуществляет при сближении атомов.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристал-лической решетки металлов.








