Тема 6. Альдегиды, кетоны и карбоновые кислоты
Урок № 3 Тема: Карбоновые кислоты. Изомерия и номенклатура.
Урок № 4 Тема: Химические свойства одноосновных карбоновых кислот.
План:
| 1. | Физические и химические свойства |
| 2. | Применение |
Получение альдегидов и кетонов
1. Окисление спиртов
Это общий способ получения альдегидов и кетонов. В промышленности в качестве окислителя используют кислород воздуха в присутствии катализаторов, в лабораторных условиях – оксид хрома (VI) или оксид меди (II) при нагревании. Первичные спирты окисляются до альдегидов, которые затем легко окисляются до карбоновых кислот.
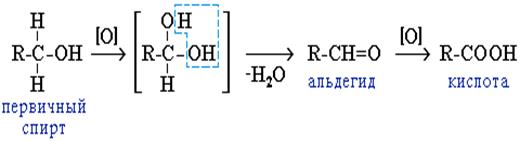
t
СН3 – СН2 –ОН + CuO → CH3 – CОН + Cu + H2O
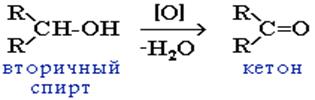
При окислении вторичных спиртов образуются кетоны, а третичные спирты в этих условиях не окисляются:
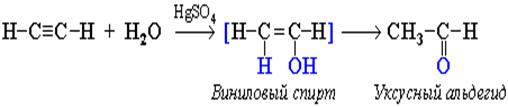
2. Гидратация алкинов (реакция Кучерова)
Ацетиленовые углеводороды присоединяют молекулу воды в кислотной среде в присутствии солей двухвалентной ртути. Поскольку присоединение протекает по правилу Марковникова, из ацетилена можно получить ацетальдегид (уксусный альдегид):
Из гомологов ацетилена получаются только кетоны:
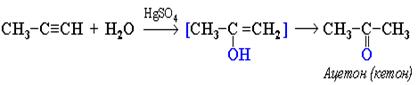
Физические свойства
Метаналь - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
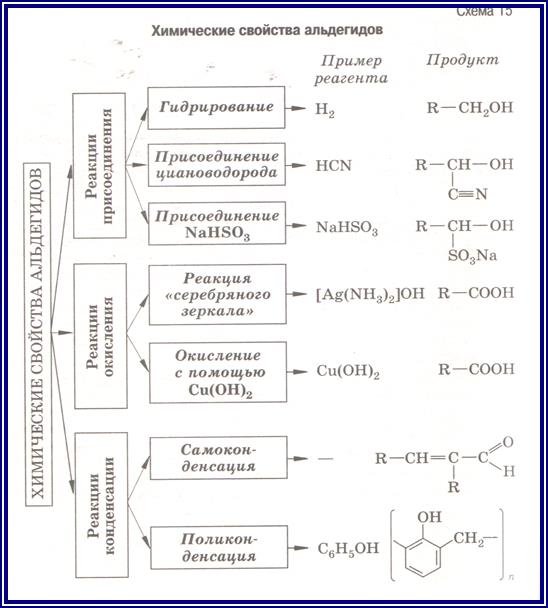
Химические свойства
Реакции присоединения.
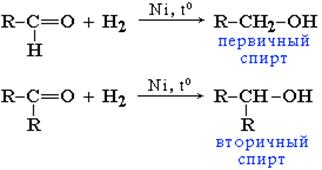
Гидрирование. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий). Альдегиды образуют первичные спирты, кетоны – вторичные спирты:
Реакции окисления альдегидов и кетонов
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II):
а) реакция "серебряного зеркала" - окисление аммиачным раствором
оксида серебра:
R–CH=O + 2[Ag(NH3)2]OH → RCOOH + 2Ag + 4NH3 + H2O
б) окисление гидроксидом меди (II) с образованием красно-
кирпичного осадка Cu2O:
R – CH = O + 2Cu(OH)2 → R - COOH + Cu2O + 2H2O
Данные реакции являются качественными на альдегидную группу.
Кетоны не вступают в реакцию "серебряного зеркала".
Физические свойства: формальдегид - газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид - бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон - бесцветная жидкость с резким запахом, растворим в воде.
В ряду алканы 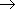 альдегиды (кетоны)
альдегиды (кетоны) 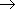 спирты растворимость в воде и температура кипения увеличивается.
спирты растворимость в воде и температура кипения увеличивается.
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь 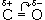 поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд ( 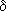 +) на атоме углерода этой группы, тем выше активность соединения.
+) на атоме углерода этой группы, тем выше активность соединения.
1. Горение:
2CH3CHO + 5O2 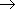 4CO2 + 4H2O
4CO2 + 4H2O
2CH3COCH3 + 9O2 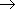 6CO2 + 6H2O
6CO2 + 6H2O
2. Присоединение (по двойной связи карбонильной группы).
Гидрирование (восстановление водородом):
HCHO + H2 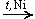 CH3OH
CH3OH
CH3—CO—CH3 + H2 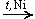 CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные.
3. Окисление:
CH3CHO + Ag2O 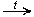 2Ag
2Ag 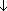 + CH3COOH (реакция "серебряного зеркала" - качественная реакция)
+ CH3COOH (реакция "серебряного зеркала" - качественная реакция)
HCHO + 2Cu(OH)2 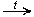 2H2O + Cu2O
2H2O + Cu2O  + HCOOH (образуется красный осадок - качественная реакция)
+ HCOOH (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются.
4. Замещение атомов водорода в углеводородном радикале (замещение происходит в  - положение, т. е. замещается атом водорода у 2-го атома углерода):
- положение, т. е. замещается атом водорода у 2-го атома углерода):
| CH3 | —CH2 | —CHO | + Cl2  CH3—CHCl—CHO + HCl CH3—CHCl—CHO + HCl
|
5. Реакции полимеризации и поликонденсации:
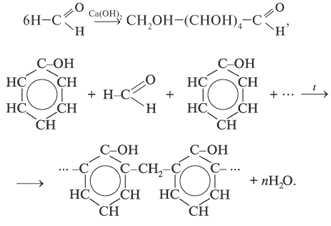
Получение альдегидов и кетонов
1. Окисление спиртов.
а) Первичных
CH3OH + CuO 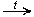 HCHO + Cu + H2O
HCHO + Cu + H2O
б) Вторичных
CH3—CH(OH)—CH3 + [O] 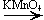 CH3—CO—CH3 + H2O
CH3—CO—CH3 + H2O
2. Дегидрирование спиртов.
а) Первичных
CH3CH2OH 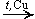 CH3CHO + H2
CH3CHO + H2
б) Вторичных
CH3—CH(OH)—CH3 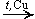 CH3—CO—CH3 + H2
CH3—CO—CH3 + H2
3. Окисление метана: CH4 + O2 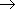 HCHO + H2O (При 500oС в присутствии оксидов азота)
HCHO + H2O (При 500oС в присутствии оксидов азота)
4. Гидратация ацетилена (реакция Кучерова; лабораторный способ):
C2H2 + H2O 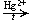 CH3CHO
CH3CHO
5. Окисление этилена: 2C2H4 + O2 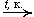 2CH3CHO
2CH3CHO
Применение альдегидов и кетонов
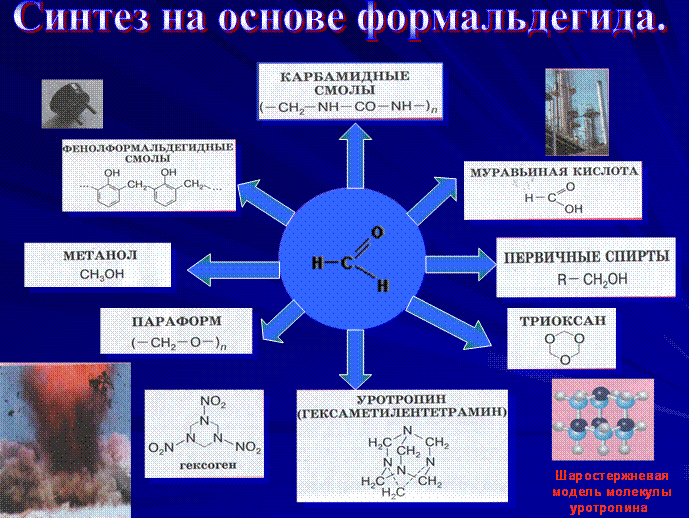
В таблице представлены основные направления органических синтезов на основе формальдегида: получение полимерных материалов (карбамидные и фенолформальдегидные смолы); образование продуктов конденсации формальдегида (триоксан, параформ); синтез взрывчатых веществ (гексоген), лекарственных препаратов (уротропин), первичных спиртов.
Мы упоминули очень интересное соединение — уротропин. Впервые оно было..получено А. М. Бутлеровым в 50-х гг. XIX в. при действии на формальдегид аммиаком. Молекулярная формула вещества (СН2)6N4 определила его химическое название — гексаметилентетрамин . Структура вещества
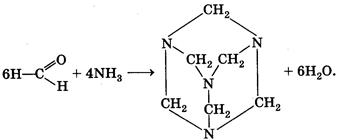
При нагревании в присутствии кислот уротропин вновь разлагается на аммиак и формальдегид. Это его свойство позволяет использовать уротропин в медицине в качестве антисептического средства. В организме человека он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы. На том же свойстве основано применение препарата кальцекс, представляющего собой комплекс уротропина с хлоридом кальция.
Большое количество формальдегида используется для производства фенолоформальдегидных смол. Их смешивают с различными наполнителями и изготавливают пластмассы, называемые фенопластами. При растворении фенолоформаль-дегидных смол в ацетоне или спирте получают лаки/
При взаимодействии формальдегида с карбамидом {мочевиной) (NН2)2СО получают карбамидную смолу, а из нее — амино -пласты. Из этой пластмассы изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звукоизоляционные пористые материалы.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
Закрепление знаний:
1. В чем различие физических свойств спиртов, альдегидов и кетонов? Каковы причины этих различий?
2. Каковы способы получения альдегидов и кетонов?
3. Каковы химические свойства предельных альдегидов?
4. Сравните альдегиды и кетоны по: а) физическим свойствам; б) составу; в) химическим свойствам; г) реакционной способности.
5. Напишите реакцию получения метил этил кетона, 2-метилгексанона-3
Задача. Формальдегид, образующийся при окислении 2 моль метанола растворили в 100г воды. Какова массовая доля формальдегида в этом растворе?








