Тема 3.Непредельные углеводороды (алкены, алкадиены и алкины)
04.10.2022
Тема 3.Непредельные углеводороды (алкены, алкадиены и алкины)
Урок № 3 Тема: Понятие об алкадиенах, как углеводородах с двумя двойными связями.
Урок № 4 Тема: Полимеризация алкадиенов - синтетические каучуки.
Элементы содержания: Понятия об углеводородах с двумя двойными связями. Химические свойства бутадиена – 1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки. Резина.
Требования к уровню подготовки: знать состав алкадиенов (диеновые углеводороды); полимеры: каучуки; химические свойства алкадиенов. Уметь составлять уравнения реакций, характеризующих способы получения и химические свойства алкадиенов.
Цели:
- познакомиться с классом алкадиенов;
- рассмотреть строение молекул, виды изомерии, номенклатуру, физические и химические свойства, основные способы получения;
- познакомиться с натуральным и синтетическим каучуком, резиной.
Тип урока: изучение нового материала
Оборудования: компьютер, мультимедийный проектор; презентация в программе Power Point. шаростержневые и объемные модели алкадиенов с различным взаимным расположением π-связей.
Подготовка: Несколько учащихся заранее получают задание подготовить сообщения о «Знакомстве европейцев с каучуком», «Истории изобретения резины».
Ход урока
Изучение нового материала
Темой нашего занятия являются соединения с двумя двойными связями. Данную тему будем изучать по ранее записанному плану. Вспомним основные пункты
План изучения класса веществ
1. Состав и строение
2. Номенклатура и изомерия
3. Физические свойства
4. Химические свойства
5. Способы получения
6. Направления применения
1. Состав и строение.
Запишем определение алкадиенов
Алкадиены - ациклические непредельные УВ, содержащие в молекуле две двойные связи между атомами углерода. Название класса: ди –два, ен – обозначение двойной связи.
Общая формула алкадиенов – СnH2n-2
Различают три вида алкадиенов:
1) алкадиены с кумулированным расположением двойных связей
СН2=С=СН–СН3 (двойные связи расположены рядом)
2) алкадиены с сопряженным расположением двойных связей
СН2= СН– СН=СН–СН3 (двойные связи разделены одной одинарной связью)
3) алкадиены с изолированным расположением двойных связей
СН2= СН– СН2–СН= СН2 (двойные связи разделены двумя и более одинарными связями)
2. Номенклатура и изомерия
У алкадиенов наблюдаются все виды изомерии, характерные для алкенов, перечислите их, пожалуйста.
(Структурная (изомерия углеродного скелета, изомерия положения кратных связей, межклассовая изомерия), пространственная (цис-, транс-) изомерия).
На слайде 5-6 представлены структурные формулы изомеров, учащиеся записывают представленные примеры в тетрадь, дают им названия.
Изомерия углеродного скелета:
СН2= СН– СН2–СН= СН – СН3 гексадиен-1,4
СН2= СН– СН–СН= СН2 3-метилпентадиен-1,4
ô
СН3
Изомерия положения кратных связей
СН2= СН– СН=СН–СН3 пентадиен – 1,3
СН2= СН– СН2–СН= СН2 пентадиен – 1,4
Межклассовая изомерия
СН2= СН– СН2–СН=СН–СН3 гексадиен-1,4
СН3–СºС–СН2–СН2–СН3 гексин-2
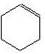
циклогексен
Пространственная изомерия
СН2= СН– СН =СН– СН3 пентадиен-1,3
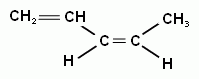
цис- пентадиен-1,3
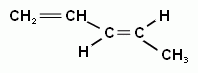
транс- пентадиен-1,3
3. Физические свойства
Учитель: Низшие диены являются газами или жидкостями, высшие диены- твердыми веществами. Более подробно рассмотрим наиболее важных представителей: бутадиен-1,3 является бесцветным газом (t кип. = -4,5 С0) с характерным запахом, изопрен – летучая жидкость (t кип. = 34,1 С0), обладает приятным запахом.
4. Химические свойства
Учитель: Сравним строение алкенов и алкадиенов. Что между ними общего?
(У алкенов имеется одна двойная связь. Алкадиены имеют две двойные связи.)
Таким образом можно предположить, что и для алкадиенов будут характерны такие же типы реакций, в частности реакции присоединения (гидрирования, галогенирования, гидрогалогенирования), реакции полимеризации. Но, из-за наличия двух двойных связей, эти реакции должны протекать несколько по иному.
Учитель: Особенностью реакций присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как по месту разрыва двойной связи (1,2-присоединение), так и к крайним углеродным атомам (1,4-присоединение).
1,2 присоединение:
СН2= СН– СН =СН2 + Сl2 ® СН2Cl– СНCl– СН =СН2
1,4 присоединение:
СН2= СН– СН =СН2 + Сl2 ® СН2Cl– СН= СН – СН2Cl
Оба вида присоединения протекают параллельно. Выход того или иного продукта определяется условиями протекания реакции и характером реагента. Так атомарный водород присоединяется в положение 1,4, а молекулярный водород над катализатором – в 1,2 положение, либо происходит полное гидрирование.
1,2 присоединение:
СН2= СН– СН =СН2 ® Н2 СН3–СН2 – СН =СН2 ® Н2 СН3–СН2 – СН2 – СН3
бутан
1,4 присоединение:
СН2= СН– СН =СН2 ®2Н СН3– СН =СН – СН3 бутен-2
Учитель: Запишите реакцию присоединения бромоводорода, учитывая правило Марковникова.
СН2= СН– СН =СН2 + HBr ® СН3 – СНBr– СН =СН2
3-бромбутен-1 (1,2 присоединение)
СН2= СН– СН =СН2 + HBr ® СН2 Br–СН= СН– СН3
1-бромбутен-2 (1,4 присоединение)
Реакции полимеризации идут преимущественно по 1,4 положениям, при этом получаются высокомолекулярные синтетические каучуки:
nСН2= СН–СН =СН2 ® (–СН2– СН =СН – СН2 –)n
бутадиен-1,3 бутадиеновый каучук
nСН2= С–СН =СН2 ® (–СН2 – С = СН –СН2 –) n
ô ô
СН3 СН3
изопрен изопреновый каучук
Запишите уравнение реакции получения хлоропренового каучука, если мономером для его получения является хлоропрен (2-хлорбутадиен-1,3).
nСН2= С–СН =СН2 ® (–СН2 – С = СН –СН2 –) n
ô ô
Сl Сl
хлоропрен хлоропреновый каучук
Каучуки бывают природные (натуральные) и синтетические. Учитель демонстрирует коллекции каучука, учащиеся отмечают в тетрадь свойства. Природный каучук является липким, эластичным, резиноподобным материалом. Синтетические каучуки обладают такими свойствами как: высокая износостойкость, устойчивость к многократным деформациям, высокая устойчивость к органическим растворителям.
Заслушаем сообщение о «Знакомстве европейцев с каучуком» (приложение 1)
Каучуки – исходное сырье для получения резины. Процесс получения резины из каучука называют вулканизацией. Получающаяся резина содержит около 5% S, и по своим свойствам значительно превосходит исходный продукт. «Историю изобретения резины» мы узнаем из сообщения (приложение 2)
5. Способы получения
Бутадиен-1,3, изопрен и другие алкадиены имеют огромное промышленное значение, они служат сырьем для получения синтетических полимеров, производство которых составляет миллионы тонн в год. Рассмотрим промышленные способы получения алкадиенов:
Дегидрирование:
 С4Н10 600 ˚С, Al2 O3, Cr2 O3 СН2= СН–СН =СН2 + 2H2
С4Н10 600 ˚С, Al2 O3, Cr2 O3 СН2= СН–СН =СН2 + 2H2
бутадиен-1,3
 СН3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
СН3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
ô ô
СН3 СН3
изопрен (2-метилбутадиен-1,3)
Дегидратация и дегидрирование спиртов (метод Лебедева):
С2Н5ОН 400-500 °С, Al2O3, ZnO СН2= СН–СН =СН2 + 2H2O + H2

Дегидрогалогенирование:
 Cl– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600 ˚С, ZnO, MgO
Cl– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600 ˚С, ZnO, MgO
® СН2= СН–СН =СН2 + 2KCl + 2 H2O
6. Направления применения
Алкадиены применяются для производства каучука и резины, о них мы уже говорили. Для закрепления этого вопроса выполним упражнение стр. 30- 35 в рабочей тетради (Габриелян, О.С. Химия 10 класс: рабочая тетрадь к учебнику «Химия 10 класс. Базовый уровень»).
Перед вами цепочки, осуществите превращения:
1 уровень
С2Н6®С2Н5Cl®С4Н10®С4Н6®Каt, t бутадиеновый каучук
2 уровень
СаС2®С2Н2®С2Н6® С2Н5Cl® С5Н12® AlCl3, t X ® Каt, t Y® Каt, t изопрен
Домашнее задание: § 5, рабочая тетрадь стр. 30-35
Приложение 1








