Количество теплоты dQ , сообщаемое системе, расходуется на изменение внутренней энергии системы dU и совершение работы против внешних сил
dQ = dU + dA.
Первое начало термодинамики выполняется в любых системах и при любых условиях. Однако первое начало не позволяет указать направление самопроизвольных процессов в природе, на этот вопрос отвечает второе начало термодинамики.
Теплота не может сама собой переходить от менее нагретого тела к более нагретому.
Однако эта формулировка не запрещает принудительно переходить теплу от менее нагретого к более нагретому. При таком переходе происходят изменения либо в термодинамической системе, либо в окружающей среде.
Невозможен такой периодический процесс, единственным результатом которого было бы превращение всей полученной машиной теплоты в работу.
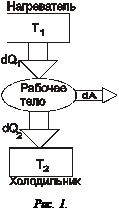
Данную формулировку можно упростить. Невозможно создать вечный двигатель второго рода. Вечным двигателем второго рода называется воображаемый двигатель, превращающий в работу всю полученную теплоту. Таким образом, даже в идеальной тепловой машине, не все полученное количество теплоты переходит в работу, часть переходит в окружающее пространство. Работа, которую совершает машина, равна
dA = dQ 1 – dQ 2,
где dQ 1 – количество теплоты, переданное рабочему телу от нагревателя, dQ 2– количество теплоты, не использованное рабочим телом и переданное холодильнику. КПД такой машины всегда меньше единицы и равен:
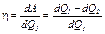 . (1)
. (1)
Следовательно, для работы тепловой машины необходимо наличие нагревателя с температурой T 1 и холодильника с температурой T 2. Причем T 1 > T 2. Французский инженер Карно показал, что из всех тепловых машин, работающих при температуре нагревателя T1 и температуре холодильника T2, наибольшим КПД обладает машина, совершающая круговой процесс, называемый циклом Карно (рис 1). КПД такой машины равен:
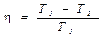 . (2)
. (2)
Таким образом, КПД любой машины не может быть больше КПД машины Карно.
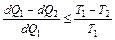 . (3)
. (3)
Здесь знак "<" относится к необратимым машинам, а знак "=" к обратимым. Обратимым циклом или процессом называется такой процесс, при котором рабочее вещество (газ) как в прямом так и в обратном процессе переходит через те же самые состояния. По схеме на рис.1 можно догадаться, почему даже идеальная машина не может иметь КПД = 1. При КПД =1 передача теплоты холодильнику отсутствует, т.е. dQ 2=0, но тогда рабочее тело нагреется до температуры нагревателя и прекратится передача тепла рабочему телу, цикл прекратится.
Энтропия
В механике равновесное состояние системы определялось минимумом энергии, однако в термодинамике этого условия уже недостаточно, например:
|
если в сосуде с перегородкой находится идеальный газ при определенной температуре, то, убрав перегородку, газ займет весь объем, переходя в соответствующее равновесное состояние, однако, температура газа останется прежней и энергия в процессе установления равновесия не изменится. Следовательно, энергия системы не может характеризовать процесс установления равновесия в системе, в этом случае используется энтропия, которая может быть получена из соотношения (3), после преобразования:
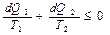 . (4)
. (4)
Величина 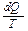 , т.е. отношение теплоты, полученной телом, к температуре процесса называется приведенной теплотой. Соотношение (4) показывает, что сумма приведенных теплот в цикле меньше или равна нулю. Так же как и раньше, знак "<" относится к необратимым циклам, а знак "=" к обратимым. Клаузиус показал, что этот результат справедлив для любого цикла и записывается:
, т.е. отношение теплоты, полученной телом, к температуре процесса называется приведенной теплотой. Соотношение (4) показывает, что сумма приведенных теплот в цикле меньше или равна нулю. Так же как и раньше, знак "<" относится к необратимым циклам, а знак "=" к обратимым. Клаузиус показал, что этот результат справедлив для любого цикла и записывается:
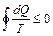 . (5)
. (5)
Выражение (5) называется неравенством Клаузиуса. Для простоты рассмотрим обратимый процесс. Из теории криволинейных интегралов известно, что если криволинейный интеграл равен нулю, то под интегралом стоит полный дифференциал некоторой функции S. Т.е. dQ / T = dS. Функция S была названа энтропией. В общем случае 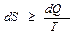 , где знак ">" относится к необратимым процессам, а знак "=" – к обратимым.
, где знак ">" относится к необратимым процессам, а знак "=" – к обратимым.
Свойства энтропии
1. Энтропией называется функция dS состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества тепла dQ , сообщенного системе, к абсолютной температуре Т последней. Функцией состояния системы называется функция, которая является полным дифференциалом, и зависит лишь от начального и конечного состояния, а не от формы пути по которому изменялась система.
2. Энтропия в изолированных системах в случае обратимых процессов не изменяется, а в необратимых процессов возрастает.
3. Энтропия – величина аддитивная. Если система состоит из нескольких частей, каждая из которых имеет свою энтропию, то энтропия всей системы равна сумме энтропий отдельных частей.
4. Энтропия является мерой беспорядка системы.
5. Энтропия является мерой «обесценивания» энергии.








