Изотермический процесс
Изотермическим процессом называется процесс, происходящий при постоянной температуре, Т= const. Два других параметра изменяются. Изотермический процесс описывается уравнением:
PV = const – закон Бойля–Мариотта, (1)
который читается: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная.
Изохорический процесс
Изохорический процесс происходит при постоянном объеме. Зависимость давления от температуры описывается уравнением:
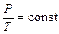 – закон Шарля, (2)
– закон Шарля, (2)
который читается: для данной массы газа при постоянном объеме давление газа линейно возрастает с увеличением температуры.
Изобарический процесс
Изобарический процесс. Это процесс, происходящий при постоянном давлении, Р= const.
Зависимость объема от температуры описывается законом:
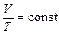 – закон Гей–Люсака, (3)
– закон Гей–Люсака, (3)
который читается: для данной массы газа при постоянном давлении объем газа линейно возрастает с ростом температуры.
Адиабатический процесс
Адиабатическим процессом называется процесс, происходящий без теплообмена с окружающей средой (dQ = 0). Он описывается уравнением Пуассона:
pVg=const, (4)
где g –постоянная адиабатического процесса. Постоянная адиабатического процесса равна:
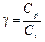 . (5)
. (5)
При адиабатическом процессе изменяются все параметры газа: давление, объем и температура.
2. Теплоемкость газа
Количество теплоты dQ, сообщенное телу при нагревании, равно
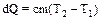 ,
,
где с – удельная теплоемкость вещества, равная количеству теплоты, сообщаемой единице массы вещества для нагревания ее на один градус.
Помимо удельной теплоемкости вводится понятие мольной теплоемкости. Мольная теплоемкость С – равная количеству теплоты, сообщаемой одному молю вещества для нагревания его на один градус.
Мольная и удельная теплоемкости связаны между собой соотношением:
С = m × с, (6)
где С – мольная теплоемкость, m – молярная масса.
Газ можно нагревать при постоянном давлении и при постоянном объеме, поэтому для газа вводятся две теплоемкости: изобарическая и изохорическая. Мольная изобарическая и мольная изохорическая теплоемкости газа связаны с соответственными соотношениями:
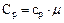 ;
; 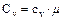 .
.
Отсюда видно, что отношение мольных теплоемкостей газа равно отношению удельных 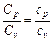 .
.
Количество теплоты, сообщенное 1 молю газа при изохорическом процессе, равно:
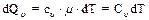 , (7)
, (7)
а при изобарическом процессе
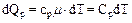 . (8)
. (8)
3. Первое начало термодинамики
Количество теплоты dQ, сообщенное термодинамической системе, расходуется на увеличение ее внутренней энергии dU и на работу dA системы против внешних сил.
dQ = dU + dA. (9)
Внутренняя энергия U– суммарная энергия всех молекул в газе для идеального газа – кинетическая энергия вращательного и поступательного движения. Для одного моля газа определяется выражением
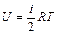 . (10)
. (10)
Работа, совершаемая газом, равна
dA = pdV. (11)
где dV – изменение его объема.
Применение первого начало термодинамики
Изотермический процесс
При этом процессе температура остается постоянной (Т=const) В этом случае dT=0 и внутренняя энергия не изменяются dU=0 dQ = dA , т.е. вся подводимая теплота расходуется газом на совершение работы против внешних сил.








