Природа химических связей
06.09.2022г
ТЭ 16-01
| Тема1. Теория химического строения органических соединений. |
Природа химических связей
Занятие №4. Тема:"Электронная природа химических связей в органических соединениях"
Дидактические цели:
Ø Образовательная
Подвести учащихся к пониманию, осознанию электронной природы химической связи в органических соединениях.
Ø Развивающая
Развить абстрактное мышление, познавательную активность, умение работать с таблицами, шаростержневыми моделями, анализировать, делать выводы, умение выделить главное.
Ø Воспитательная
Воспитать уверенность к себе, самостоятельность, аккуратность, внимательность, культуру труда, любовь к выбранной профессии.
Учебные элементы:
1) Электронное облако и орбиталь.
2) Форы орбиталей.
3) Гибридизация.
4) Одинарная связь.
5) Двойная связь.
6) Тайная связь.
7) δ – (сигма) и - (пи) связи.
ХОД УРОКА
Ответить на вопросы:
1. Что понимают под состоянием электронов в атоме?
- это совокупность информации об энергии определенного
электрона (ē) и пространстве, в котором он находится.
2. Что называют электронным облаком или орбиталью?
- это пространство вокруг ядра атома, в котором наиболее вероятно пребывание ē.
3. О какой степени вероятности можно говорить в данном случае?
- 90 %.
4. Какие первых два типа орбиталей вам известны?
- два известных типа – S – P.
5. Какую форму имеют эти орбитали?
- S – форму шара (круга) – (показывают трафареты);
- P – форму правильной гантели.
б) объяснение нового материала:
1. строение атома углерода 2-х и 4-х валентных;
2. электронно-графические формулы.
Все органические вещества содержат углерод. В молекулах органических веществ атом углерода переходит в возбужденное состояние (показываю на экране).
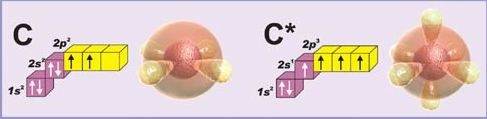

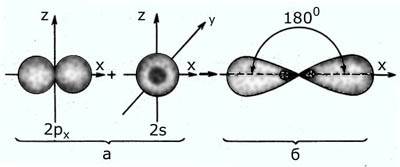
1. Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на S – орбитали сферической формы
3 электрона на трех P – орбиталях, орбитали имеют форму гантели и расположены под углом 90º.
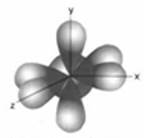
рис. Атом углерода в возбуждённом состоянии (s1px1py1pz1)
Таким образом, можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на S – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
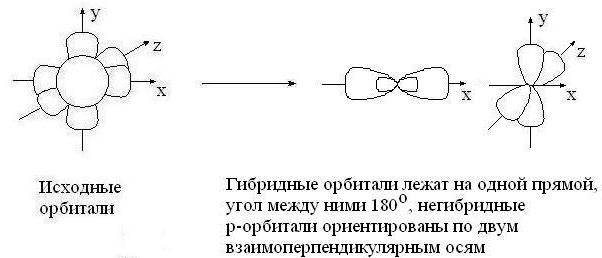
4. В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трёх состояний гибридизации: sp3, sp2, sp.
sp3 – гибридизация: происходит смешение одной S и трёх P орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Объяснение Характерен для алканов.
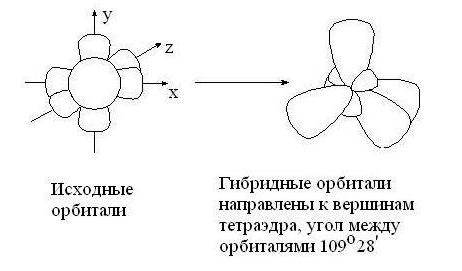
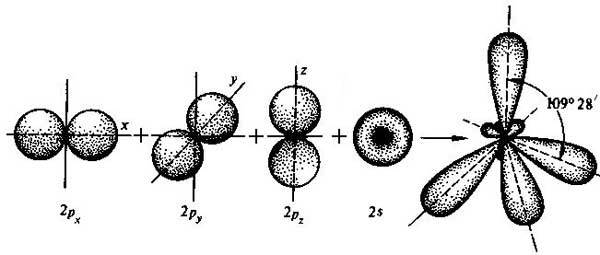
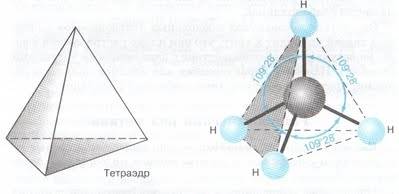
рис. Строение молекулы метана СН4 (тетраэдрическое)
sp2 – гибридизация: происходит смешение одной S и двух P орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные δ – связи
Объяснение Характерен для алканов.
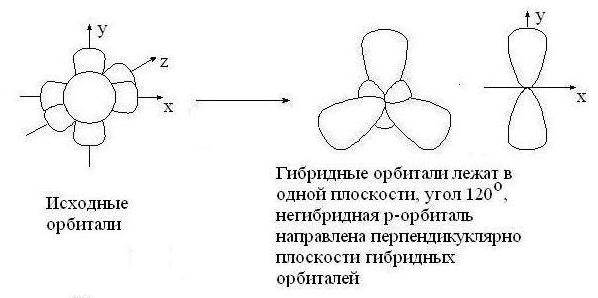
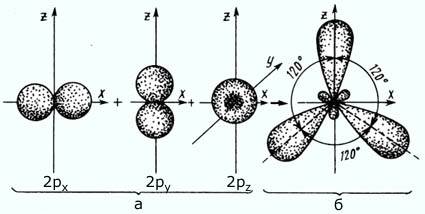
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования δ – связей и участвует в образовании - связи.

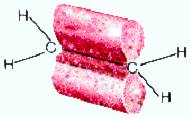
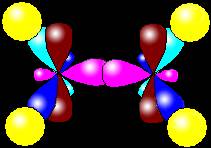
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
sp – гибридизация: происходит смешение одной S и одной P орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные δ – связи.
Объяснение Характерен для алканов.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две - связи.
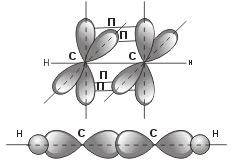
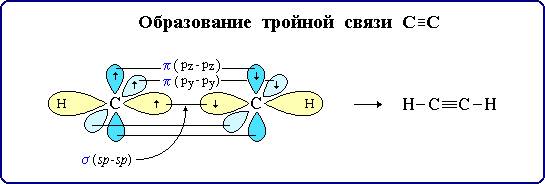
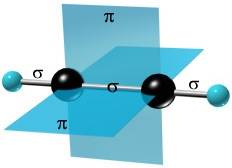

рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
Упражнение по закреплению и совершенствованию знаний.
1. В предложенных органических соединениях у каждого атома С определите:
а) тип гибридизации;
б) количество δ (сигма) и (пи) связей.
I вариант II вариант

 Н Н Н Н
Н Н Н Н






 С = С = С Н С = С – С
С = С = С Н С = С – С

 Н С Н Н Н Н С = С – Н
Н С Н Н Н Н С = С – Н
Н
2. Какие формы в пространстве имеют перечисленные ниже молекулы, какая их геометрия?
Метан Этен Этин
СН4 С2Н4 С2Н2
Домашнее задание:
- учить конспект;
- повторить понятия "гомологи", "изомеры".








