Устройство и принцип работы гальванического элемента (ГЭ)
ГЭ состоит из двух электродов, замкнутых проводниками первого и второго рода.
Проводник первого рода представляет собой металл, по которому движутся избыточные электроны.
Проводник второго рода – это раствор электролита, в котором по электролитическому мостику движутся анионы электролита.
Электрод – это система, состоящая из металлической пластины, погруженной в раствор электролита. Роль электролита может выполнять соль этого же металла.
В зависимости от природы электродов, состава и концентрации электролитов различают разные типы ГЭ:
1. Элемент Якоби – Даниэля состоит из Zn и Cu электродов, погруженных в сосуды с растворами сульфатов этих металлов. Растворы электролитов соединены между собой сифонной трубкой, наполненной смоченным в электролите агар-агаром. Сифонная трубка выполняет роль электролитического ключа.
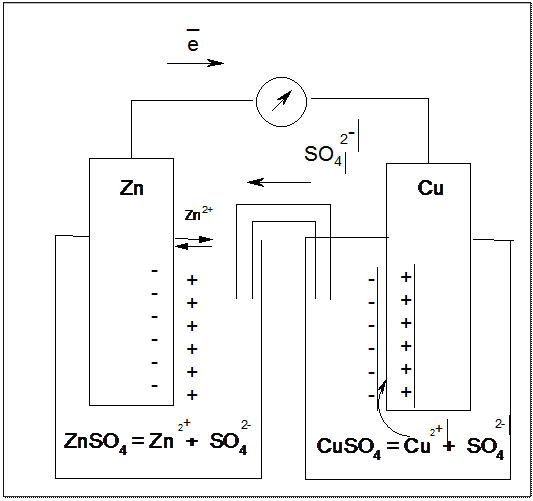 При погружении цинковой пластины в раствор собственной соли часть ионов цинка из пластины перейдет в раствор, в результате чего цинковый пластина зарядится отрицательно, а раствор положительно. В системе цинк-электролит возникает ДЭС, который находится в состоянии равновесия.
При погружении цинковой пластины в раствор собственной соли часть ионов цинка из пластины перейдет в раствор, в результате чего цинковый пластина зарядится отрицательно, а раствор положительно. В системе цинк-электролит возникает ДЭС, который находится в состоянии равновесия.
На медной пластинке при погружении ее в раствор собственной соли происходит обратный процесс – переход ионов меди из раствора в вакансии в узлах металлической решетки, в результате чего пластинка зарядится положительно, а раствор отрицательно. В системе медь-электролит также возникает ДЭС, который находится в состоянии равновесия.
После соединения электродов проводником первого рода, избыточные электроны с цинкового электрода начнут перемещаться на медный электрод. В результате чего уменьшится отрицательный заряд цинковой пластины и нарушится равновесие ДЭС. Для восстановления равновесия катионы цинка с пластины начнут переходить в раствор и цинковый электрод начнет окисляться.
Электрод, на котором происходит процесс окисления, называют анодом. Роль анода в ГЭ всегда выполняет более электрохимически активный металл:
А: Zn - 2ē ⇄ Zn2+ - анодный процесс (окисление)
Электроны, пришедшие на медный электрод уменьшат его положительный заряд, поэтому для восстановления равновесия катионы меди из раствора начнут переходить на пластину восстанавливаться.
Электрод, на котором происходит процесс восстановления, называется катодом. Роль катода в ГЭ всегда выполняет менее активный металл:
К: Cu2+ + 2ē ⇄ Cu – катодный процесс (восстановление)
При замыкании цепи электролитическим ключом избыточные сульфат анионы из емкости с раствором CuSO4 начнут перемещаться в емкость с раствором ZnSO4.
В результате между пластинками возникает разность потенциалов, которая приводит к возникновению электрического тока.
В основе работы элемента ГЭ лежит следующая токообразующая ОВ реакция:
Zn + Cu2+ ⇄ Zn2+ + Cu (ионное уравнение)
Zn + CuSO4 ⇄ ZnSO4 + Cu (молекулярное уравнение)
Краткая схема ГЭ Я - Д записывается так:
А: Zn0 / Zn2+ // Cu2+ / Cu0 :К
А: Zn0 / ZnSO4// Cu SO4 / Cu0 :К
Эффективность работы ГЭ характеризует его ЭДС, которая вычисляется по формуле:
ЭДС = Ек – Еа, где Ек- электродный потенциал катода, Еа- электродный потенциал анода
ЭДС элемента Я - Д в стандартных условиях равна: ЭДС = Е Cu2+ / Cu0 – Е Zn0 / Zn2+ = 0,344 – (- 0,763) = 1,1В
Данный ГЭ будет работать до тех пор, пока полностью не окислятся атомы цинка или полностью восстановятся ионы меди. Элемент Я - Д является обратимым, т.к. пропускание электрического тока в обратном направлении вызовет обратную реакцию, т.е. растворение меди и осаждение цинка.
2. Элемент Вольта. В элементе Вольта цинковый и медный электроды погружены в раствор серной кислоты. При работе данного ГЭ на цинковом электроде (аноде) происходит окисление цинка:
А: Zn - 2ē ⇄ Zn2+ - анодный процесс
а на медном электроде (катоде) в отличие от элемента Я - Д восстановление ионов водорода из серной кислоты:
К: 2Н+ + 2ē ⇄ Н20 – катодный процесс.
Указанные процессы протекают по уравнениям:
Zn + 2Н+ ⇄ Zn2+ + Н2 (ионное уравнение)
Zn + Н2SO4 ⇄ Zn SO4 + Н2 (молекулярное уравнение)
Химическая цепь, лежащая в основе работы данного ГЭ записывается так:
А: Zn0 / Н2SO4 // Н2SO4 / Н2 0 :К
ЭДС элемента Вольта, как и любого другого элемента определяется по формуле:
ЭДС = Ек – Еа
Элемент Вольта является необратимым ГЭ.
3. Концентрационные ГЭ состоят из двух одинаковых электродов (изготовленных из одного металла), которые погружены в растворы солей этих металлов различной концентрации С1 и С2, причем С1 > С2
Из уравнения Нернста следует, что чем больше концентрация ионов металла в растворе, тем менее отрицательное значение будет принимать электродный потенциал и наоборот, чем меньше концентрация ионов металла в растворе, тем более отрицательное значение будет принимать электродный потенциал. Поэтому металл, погруженный в более концентрированный раствор будет выполнять роль катода, а в менее концентрированный роль анода.
При работе данного ГЭ на аноде, происходит процесс - окисления Al0, а на катоде процесс восстановления Al+3:
А: Al0 - 3ē ⇄ Al3+ - анодный процесс
К: Al3+ + 3ē ⇄ Al0 – катодный процесс
Концентрационный ГЭ будет работать до тех пор, пока не выровняются концентрации растворов.
Химическая цепь, лежащая в основе работы данного ГЭ записывается так:
А: Al0 / C1 Al(NO3)3 // C2 Al(NO3)3 / Al0 :К
Для определения ЭДС данного элемента применяют уравнение Нернста: Ес = Ео + 0,059´ℓg Сm / n,, но т.к. металл в концентрационной цепи один и тот же, то выражение примет вид: ЭДС = 0,059´ℓg С1/С2
В процессе работы ГЭ его ЭДС постепенно уменьшается. Явление изменения значений электродных потенциалов анода и катода при прохождении электрического тока называется поляризацией. Различают анодную и катодную поляризацию. При катодной поляризации потенциал катода становится более отрицательным. При анодной поляризации потенциал анода становится более положительным. Это объясняется следующими причинами:
1. Скорость перехода электронов с анода на катод больше скорости перехода ионов металла из электрода в раствор. В результате значение электродного потенциала смещается в сторону положительных значений.
2. В процессе растворения анода, концентрация ионов металла в прианодном пространстве возрастает, что также приводит к увеличению значения электродного потенциала.
3. Скорость перехода электронов с анода на катод больше скорости восстановления ионов металла на катоде, что смещает потенциал в сторону отрицательных значений.
Поляризация является отрицательным явлением, т.к. снижает ЭДС ГЭ.
Для борьбы с поляризацией в раствор электролитов добавляют вещества деполяризаторы, например О2, MnO2, K2Cr2O7.








