Понятие об электродных потенциалах, электрохимических процессах
В основе всех электрохимических процессов лежит теория возникновения скачка потенциалов на границе металл - электролит, предложенная Нернстом. Основные положения этой теории заключаются в следующем:
1. Металлы имеют кристаллическое строение. В узлах решеток расположены катионы и атомы, а в межузловом пространстве электроны, называемые электронным газом. 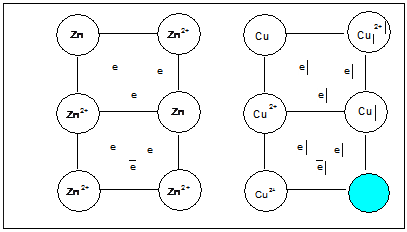
Оторвавшиеся электроны переходят в межузловое пространство и участвуют в образовании металлической связи.
2. Абсолютно нерастворимых веществ не существует.
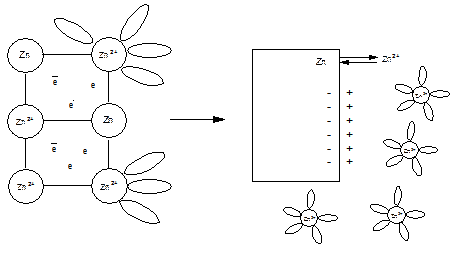
При погружении металлической пластинки в полярный растворитель она начнет растворяется: полярные молекулы взаимодействуют с ионами металла, находящимися на поверхности. В результате этого взаимодействия пластинка заряжается отрицательно, а прилегающий слой положительно вследствие, чего между металлом и водой создается разность потенциалов, называемая электродным потенциалом металла.
Электродный потенциал зависит от следующих факторов:
1. Природа металла: чем меньше энергия ионизации металла, тем более отрицательное значение принимает электродный потенциала металла и тем более металл электрохимически активен.
2. Активность металла: Она определяется положением металла в ряду стандартных электродных потенциалов. Чем левее расположен металл в этом ряду, тем выше его восстановительная активность и ниже окислительная способность его катиона в растворе и наоборот.
В связи со значением электродных потенциалов металлы делятся на три группы:
1 Активные от Li до Zn
2. Средней активности от Fe до H
3. Неактивные правее H.
Все металлы: активные, средней активности и неактивные в воде, растворах кислот заряжаются отрицательно, а раствор положительно. 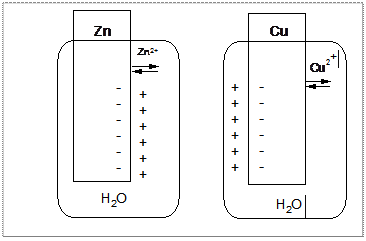
Активные металлы в растворах собственных солей при стандартных условиях заряжаются отрицательно, а неактивные положительно.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Электрохимия – это раздел химии изучающий взаимные превращения химической и электрической энергии. В химических реакциях, идущих под воздействием электрического тока (электролиз) электрическая энергия превращается в химическую. В химических источниках тока, в частности, в гальванических элементах энергия химической реакции преобразуется в электрическую энергию.








