Правило коагуляции
1. Любые электролиты могут вызвать коагуляцию, однако заметное воздействие они оказывают при достижении определенной концентрации.
Минимальная концентрация электролита, которая вызывает коагуляцию называется порогом коагуляции γ, моль/м3.
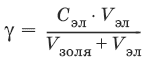
где Сэл – концентрация электролита-коагулятора; V эл – объем добавленного электролита; V золя(обычно 10 мл) – объем золя.
Порог коагуляции определяется по началу помутнения раствора, по изменению окраски раствора или по началу выделения дисперсной фазы в осадок.
2. Коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду потенциалопределяющих ионов мицеллы, причем его коагулирующая способность выражается тем сильнее, чем выше заряд – правило значности или правило Шульце-Гарди.
Если принять коагулирующую способность однозарядного иона за единицу, то коагулирующая способность двухзарядных ионов будет на порядок больше, а трехзарядного – на два порядка.
Таблица 1
Значения порога коагуляции различными электролитами
для двух золей
| Золь As2S3 | Золь Fe(OH)2 | ||||
| электролит | коагулирующий ион (катион) | γ, моль/м3 | электролит | коагулирующий ион (анион) | γ, моль/м3 |
| NaCl | Na+ | KCl | Cl− | ||
| KCl | K+ | KBr | Br− | ||
| MgCl2 | Mg2+ | 0,72 | KJ | J− | |
| CaCl2 | Ca2+ | 0,65 | KNO3 | NO3− | |
| AlCl3 | Al3+ | 0,092 | K2SO4 | SO42− | 0,2 |
3. В ряду однозарядных катионов и анионов коагулирующая активность изменяется следующим образом:
Li+→Na+→K+→Rb+
От иона лития к иону рубидия коагулирующая активность возрастает.
Cl−→ Br−→ J−→СNS−
От Cl−к СNS− коагулирующая активность возрастает.
Эти ряды называются лиотропными рядами или рядами Гофмейстера.
4. В осадках, получаемых при коагуляции электролитами, всегда присутствуют ионы, вызывающие ее.
Пример: при коагуляции золя As2S3, частицы которого имеют отрицательный заряд хлоридом бария в осадке содержится некоторое число ионов Ba2+.








