3 Механическая,обтурационная (подпеченочная) желтуха.
Закупорка желчных протоыэв (камень, опухоль, пфазиты, стеноз общего желчного протока при хроническом дуодените). При полной закупорке общего желчного протока ко нъюгиро ванный билирубин не поступает в кишечник, не образуется уробилиноген и как следствие - ахоличный кал. При нарастании объема желчи в желчных капиллярах происходит их разрыв, и прямой билирубин попадает в кровь. В крови резко увеличивается прямой билирубин при незначительном увеличении непрямого билирубина. Моча интенсивно окрашена прямым билирубином. Для механической желтухи характерен зуд кожи у больных, обусловленный задержкой желчных кислот.
резкое увеличение в крови прямого билирубина, незначительное увеличение непрямого билирубина, ахоличный кал и положительная реакция мочи на желчные пигменты - наличие прямого билирубина.
НАСЛ Е ДСТВЕННО - ОБУСЛОВЛЕННЫЕ ЖЕЛТУХИ .
Кроме приобретенных желтух наблюдаются и врожденные нарушения обмена билирубина. Эти заболеванияотносят к группе гепатозов.
1 .Синдром Жильбера.встречается у 2-5 %населения.Он связан со снижением поглощения билирубина гепатоцитами в результате дефекта бел ков-переносчиков: либо лигандина, либо протеина Z. Заболевание наследуется по аутосомно-рецессивному типу. В крови повышена концентрация непрямого билирубина.При этом синдроме могут наблюдаться легкое
недомогание и болезненность печени при надавливании, но другах физикальных признаков нет.
2.СиндромКриглера - Наджара (Найяра).отсутствие (или недостаток)УДФ-глюкуронилтранферазы. В крови увеличен непрямой билирубин. Введение фенобарбитала не дает эффекта и больные погибают в первые два года жизни.
3.СиндромДабина- Джонсона.Развивается вследствие дефекта секреции прямого билирубина в желчь. При данном заболевании имеется дефект АТФ-зависимой транспортной системы. У больных повышен как прямой, так и непрямой билирубин.
4.Синдром Ротора.Это хроническая семейная гипербилирубинемия. Имеется сочетание снижения глюкуронирования и нарушения транспорта билирубина через мембрану клеток в желчь. При данном виде желтухи превалирует накопление прямого билирубина и частично увеличен непрямой билирубин.
29)Цикл Кребса— центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ.
Цикл Кребса — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.
У эукариот все реакции цикла Кребса протекают внутри митохондрий, причём катализирующие их ферменты, кроме одного, находятся в свободном состоянии в митохондриальном матриксе, исключение составляет сукцинатдегидрогеназа, которая локализуется на внутренней митохондриальной мембране, встраиваясь в липидный бислой. У прокариот реакции цикла протекают в цитоплазме.
При работе цикла Кребса окисляются различные продукты обмена, в частности токсичные недоокисленные продукты распада алкоголя, поэтому стимуляцию цикла Кребса можно рассматривать как меру биохимической детоксикации.
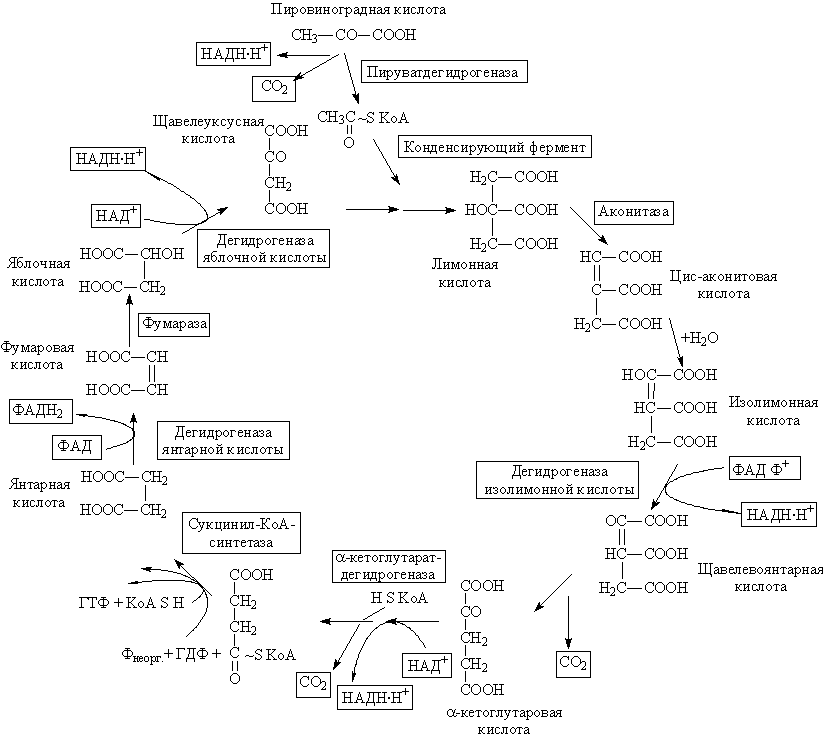
Общее уравнение одного оборота цикла Кребса:Ацетил-КоА → 2CO2 + КоА + 8e−
Регуляция цикла
Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалацетат(субстрат Цикла Кребса) + АДФ + Фн.
Функции
Интегративная функция — цикл является связующим звеном между реакциями анаболизма и катаболизма.
Катаболическая функция — превращение различных веществ в субстраты цикла:
Жирные кислоты, пируват,Лей,Фен — Ацетил-КоА.
Арг, Гис, Глу — α-кетоглутарат.
Фен, тир — фумарат.
Анаболическая функция — использование субстратов цикла на синтез органических веществ:
Оксалацетат — глюкоза, Асп, Асн.
Сукцинил-КоА — синтез гема.
CО2 — реакции карбоксилирования.
Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны водорода в виде трех НАДН.Н+ и одного ФАДН2.
Энергетическая функция — 3 НАДН.Н+ дает 7.5 моль АТФ, 1 ФАДН2 дает 1.5 моль АТФ на дыхательной цепи. Кроме того в цикле путем субстратного фосфорилирования синтезируется 1 ГТФ, а затем из него синтезируется АТФ посредствам трансфосфорилирования: ГТФ + АДФ = АТФ + ГДФ.
Мнем. правило- Целый Ананас И Кусочек Суфле Сегодня Фактически Мой Обед, что соответствует ряду — цитрат, (цис-)аконитат, изоцитрат, (альфа-)кетоглутарат, сукцинил-CoA, сукцинат, фумарат, малат, оксалоацетат.
№30 Дыхательная цепь. Окисление субстратов в процессе дых можно представить как перенос е и протонов, т е целого атома Н от орган вещ-в на О2. Включает много этапов, учавствует ряд промежут переносщиков образующих цепь переноса е или дыхат цепь, котор локализуется в митохондриях. Митохондрии имеют внутр (избирательно прониц) и наруж (проницаема для молек с м=5000) мембрану. Компоненты цепи переноса е распоожены по внутр мембр митох.Н+ от первичных доноров вводится в дых цепь с участием НАД-зависимой и ФАД-завис дегидрогеназ. НАД-завис дегидрогеназа находится в матриксе митохондрий, а перенсят Н+ на НАД обазую НАД*Н2 . НАД*Н2 дегидрогеназа, которая предсавляет собой флавинмононуклеотид (ФМН) содержит фермент. Затем следует убихинон (CоQ), который принимая протоны и электроны превращается в убихинол (СоQH2). Затем в дых цепи пути е и протонов расходятся, перенос е осущ с помощью цитохромов, которые представляют собой гемопротеины (атом Fe в гемме цитохромов может менять валентность присоединяя или отдавая е). Цитохром дых цепи обозначаются ВС1,С,А,А3. Электрон последовательно проходят через атомы Fe ВС1, затем поступают на цитохром С, протоны при этом освобождаются в межмембранное пространство. Коэффициент 2 обусловлен тем, что с QH2 передаются 2е, а цитохромы за 1 цикл переносят по 1 электрону. Комплекс 4: А, А3 действуют как цитохром С оксидаза. По мимо гема он содержит Сu, который участвует в переносе е меняя валентность этот комплекс переносит е с цитохрома С на О2. О2 поступающий в митохондриииз крови связывается с атомом Fe в геме цитохром А3 в форме молекулы О2. Затем каждый из атомов О2 последовательно присоединяет по 2е и 2 протона превращаясь в воду. Цитохром оксидаза имеет более низкую константу Михаэлиса, то есть большее сродство к О2 чем Нв, то есть клетки всасывают О2 из крови. Таким путем через дых цепь Н+ пищевых вещ-в достигают конечного акцептора О2. ФАД-зависимые дегидрогиназы перносят Н+ сразу на СоQ. Комплексы 1,2,3 содержат негеминовое Fe (Fe-серные ценры) они тже участвуют в ереносе е, Fe в них ножет быть восстановленным Fe2+ или окисленным Fe3+ .
№31 Окислительное фосфорилирование. Хемо-аосматическая теория Митчелла. По его мнению энерния переноса электронов и протонов вдоль дыхательной цепи первоначальна сосредотачивается в виде протонного потенциала или электорохим градиента ионов Н создающего движение ч/з мембрану заряженных протонов. Диффузия протонов обратно сопряжена с фофсфорилированием кот осущ-ся АТФ систетаза. Дыхание слвершает асматическую работу, т.е концентрирует протоны в межмембранном пространстве митохондрий и электрическую разность потенциалов кот используется АТФ синтетаза на синтез АТФ. Сочетание этих двух фун-ций дых и фосфор дало основание назвать гипотезу хим осматической или протондвижущей, поскольку движ силой фосфорилирования явл-ся протонный потенциал. Синтез одной мол АТФ из АДФ сопровождается проникновением 2 протонов из внешней среды внутрь митохондрий. Разность протонов выравнивается и происходит разрядка мембраны, исчезает электр потенциал.
Механизм образования эл потенциала. Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены, скорость использования АТФ регулирует скорость потока электронов в цепи переносов электронов, АТФ не используется, поток электронов прекращается. Распад АТФ и образование из него АДФ увеличивает окисление субстратов и поглощение О2. Зависимость интенсивности дыхания митохондрий от концентрации АДФ = дыхательная концентрация. В рез-те его действия скорость синтеза АТФ соответствует потребностям клеток в энергии. Общее сод-ие АТФ в организме 30-50 гр, но каждая молекула АТФ живет меньше 1 мин. Коэфф. фосфорилирования. В расчете на каждый атом поглащенного кислорода или на пару переносимых электронов от НАД*Н2 к О2, митохондрии образуют 3 молекулы АТФ. Отношение кол-ва связанной Н3РО4 и кол-ву поглащенного О2 называют коэффициентом фосфолирирования или стехиометрическим коэф. Он равен меньше 3. Если первичной дегидрогеназой является ФАД, то в цепи переноса действуют только 2 пункта перекачки протонов и стех коэф меньше 2. А так как в среднем = 2,6 – 2,8. В митохондриях не всегда окисление сопряено с фосфолорированием, такой путь окисления сульфатом называется нефосфорилированным или свободным. Энергия идет на образование тепла..
32 Активация процессов свободнорадикального окисления представляет собой важный фактор поражения мозгового вещества в условиях острой и хронической ишемии.
Изучение процессов свободнорадикального окисления (СРО) в организме человека имеет важное значение для понимания их роли в нормальной жизнедеятельности и в развитии патологических состояний. В настоящее время не вызывает сомнений, что СРО участвует в развитии ряда заболеваний человека в качестве ключевого звена патогенеза, а в остальных случаях может существенно отягощать течение любой патологии. Не случайно усиление СРО биологически значимых молекул рассматривается как неспецифический патологический процесс, сопровождающий любое заболевание.
Важно заметить, что вредным является не простое повышение уровня СРО, а нарушение некоего определенного (физиологического) баланса между интенсивностью СРО и функциональной активностью антиоксидантной системы (АОС) организма. Выяснение реальной взаимосвязи этого дисбаланса с развитием патологических изменений является достаточно трудным в силу сложности процессов СРО и многокомпонентности АОС. В ходе своих исследований мы пытаемся нащупать методологические подходы, которые позволили бы создать доступный комплекс анализов, достаточный для оценки указанной взаимосвязи.
33 Свободные радикалы отличаются от обычных молекул тем, что у них на внешней электронной оболочке имеется неспаренный (одиночный) электрон. Неспаренный электрон в радикалах принято обозначать точкой. Например, радикал гидроксила обозначают как HO·, радикал перекиси водорода как HOO·, радикал супероксида как ·OO- или O2·-. Ниже даны формулы трех радикалов этилового спирта: CH3CH2O·; CH3·CHOH; CH3CH2O· Свободным радикалом называется частица - атом или молекула, имеющая на внешней оболочке один или несколько неспаренных электронов. Это делает радикалы химически активными, поскольку радикал стремится либо вернуть себе недостающий электрон, отняв его от окружающих молекул, либо избавиться от "лишнего" электрона, отдавая его другим молекулам. В особом положении оказалась молекула кислорода (диоксигена), которая содержит на внешней оболочке целых два неспаренных электрона. Таким образом, диоксиген - это бирадикал и, подобно другим радикалам, обладает высокой реакционной способностью. Первичные радикалы и реактивные молекулы. Все радикалы, образующиеся в нашем организме, можно разделить на природные и чужеродные. В свою очередь природные радикалы можно разделить на первичные, вторичные и третичные. Первичными можно назвать радикалы, образование которых осуществляется при участии определенных ферментных систем. Прежде всего к ним относятся радикалы (семихиноны), образующиеся в реакциях таких переносчиков электронов, как коэнзим Q (обозначим радикал как Q·) и флавопротеины. Два других радикала - супероксид (·OO-) и монооксид азота (·NO) также выполняют полезные для организма функции, которые будут подробнее рассмотрены в соответствующих разделах. Из первичного радикала - супероксида, а также в результате других реакций, в организме образуются весьма активные молекулярные соединения: перекись водорода, гипохлорит и гидроперекиси липидов. Реактивные молекулы: перекись водорода, гидроперекиси липидов, пероксинитрит, - образуются в реакциях, одним из участников которых в большинстве случаев является радикал, а иногда - диоксиген, который, впрочем, тоже имеет неспаренные электроны на внешней электронной оболочке. В свою очередь, эти молекулы, а наряду с ними - гипохлорит, охотно образуют радикалы в присутствии ионов металлов переменной валентности, в первую очередь - ионов двухвалентного железа. Такие радикалы мы будем называть вторичными; сюда относятся радикал гидроксила и радикалы липидов. Вторичные радикалы, в отличие от первичных, образуются в неферментативных реакциях и, насколько известно в настоящее время, не выполняют физиологически-полезных функций. Напротив, они обладают разрушительным действием на клеточные структуры и с полным основанием могут быть названы вредными радикалами. Именно образование вторичных радикалов (а не радикалов вообще) приводит к развитию патологических состояний и лежит в основе канцерогенеза, атеросклероза, хронических воспалений и нервных дегенеративных болезней. Для защиты от повреждающего действия вторичных радикалов в организме используется большая группа веществ, называемых антиоксидантами, к числу которых принадлежат ловушки, или перехватчики свободных радикалов. Примером последних служат альфа-токоферол, тироксин, восстановленный убихинон (QH2) и женские стероидные гормоны. Реагируя с липидными радикалами, эти вещества сами превращаются в радикалы антиоксидантов, которые можно рассматривать как третичные радикалы. Наряду с этими радикалами, постоянно образующимися в том или ином количестве в клетках и тканях нашего организма, разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например, светом лазера. Такие радикалы можно назвать чужеродными. К ним принадлежат также радикалы, образующиеся из попавших в организм посторонних соединений, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений.
34. ПОЛ играет огромную роль в клетки патологии. Р-ция протекает в несколько стадий (инициирование цепи, продолжение, разветвление и обрыв). Инициирование цепной реакции начинается с того что липидный слой мембран внедряется свободный радикал. Он вступает в хим р-цию с полененасыщ жирными к-ми, входящими в состав биол мембран. При этом образуются липидные радикалы. Они вступаят в р-цию с растворенными в среде молекулярным О2, при этом образуется новый свободный радикал липоперекиси. Он атакует одну из соседних молекул фосфолипидов с образованием гидроперикиси липида и новым радикалом чередование 2 последних реакций представляет собой цепную реакцию ПОЛ. ПОЛ ускоряется в присутствии небольшого кол-ва 2х валентного железа, в этом случае происходит разветвление цепей в рез-те взаймодействия железа с гидроперекисью липидов. В биол мембранах цепи могут состоять из 10 и больших звеньев. Цепь обрывается в рез-те взаимодействии свобод. радикалов с антиоксидантами, ионами Ме с переменноц валентностью или друг с др.
Следствие ПОЛ:
а) образуется белковые агрегаты хрусталика глаза = помутнение
б) иноктивация Са-АТФ-синтетаза-> Замедлению Са из Кл и в Кл -> увел концентр Са -> повреждение Кл
в) продукты ПОЛ непосредственно увелич проницаемость липидного слоя для Н и Са -> не синтезир АТФ-> уменьшение стабильности липидного слоя
Антиоксиданты водой фазы: 1 СОД
2. каталаза
3. глутотионпироксидаза
4. комлексоны связывающие ионы Fe
5. витамин С и РР
6. мочевая к-та
7. цируллоплазмин
антиоксиданты липидной фазы. Цепные реакции липидной фазы ведут свбодные радикалы L* и LOO* разветвленных цепей происходит при ваимодействии гидропироксидных липидов с Fe2+ следовательно все соеинения снижая концентрацию перечисленных вещ-в, выполняют функцию антиоксидантов: фосфолипаза, глутотионпироксидаза, ловушки радикалов комплексоны, витамины Е и К, холестерин. Активация ПОЛ обнаруживается по накоплению первичных (гидропероксидазы коньюгирующие диены), или вторичные (производные МДА, пентан), или по резкому снижению уровня липидных антиоксидантов.
присоединяться к Нв.
№35.микросомальное окисление.В мембран гладких эндоплазмацитов ретикулома а также в митохондриях мембран некоторых органов есть окислительная система которая катализирует гидроксилированием большого числа разных субстратов. Эта окислительная система состоит из 2 цепей окислен НАДФ зависимого и НАД зависимого,НАДФ зависимая монооксидазная цепь состоит из вос-ого НАДФ,флавопротеида с коферментом ФАД и цитохрома Р450. НАД Н зависим цепь окисления содержит флавопротеид и цитохром В5. обе цепи могут обмениваться е.при выделении эндоплазматического ретикулума из Кл мембран распад-ся на части,каждая из которых образует замкнутый пузырёк-микросому.окисление с участием цР450 обычно изучают используя пр-ты лизосом-микросомальное окисление. цР450 катализирует образование гидроксильных гр при синтезе желчных кислот,стероидных гормонов,при катаболизме ряда в-в и обмене чужерод соед. цР450,как и все цитохромы относится к гемопротеидам,а белковая часть представлен одной полипептидной цепью,М=50тыс.способен образовывать комплекс с СО2 –имеет максимальное поглащение при 450нм.окисление ксенобиотиков осуществл с различ скоростью извест индукции и ингибиторы микросомальных систем окисления. Скорость окисления тех или иных в-в может ограничев-ся конкуренц за фермент комплекс микросом фракции. Так одновременное назначение 2 конкурирующ лек приводит к тому,что удаление одного из них может замед-ся и это приведёт к накоплению его в организме.В др случ лек может индуцировать активацию сис-мы микросом оксидаз-ускорен устранение одновремен назначенных др пр-ов.Индукторы микросом можно использовать и как лек ср-ва при необходимости активировать процессы обезвреживания эндоген метаболитов. Помимо реакций детоксикац ксенобиотиков сис-ма микросомального окисления может вызывать токсификацию исходно инертных в-в.
Цитохром Р450 – гемопротеин, содержит простетичесую группу – гем, и имеет участки связывания для О2 и субстрата (ксенобиотика). Молекулярный О2 в триплетном состоянии инертен и не способен взаимодействовать с орган соединениями. Чтобы сделать О2 реакционоспособным необходимо его превратить в синглетный, используя ферментные системы его восстановления (моноксигеназная система).
№36. Строение нуклеотидов. Каждый нуки сод-ит 3 хим-и разл-ых компонента:
*гетероциклическое азотистое состояние
пуриновые: аденин (аденозинмонофосфат-АМФ), гуанин (гуанозинмонофосфат-ГМФ)
- пиримидиновые: цитозин (цитидинмонофосфат-ЦМФ), тимин (тимдинмонофосфат-ТМФ), урацил (уридинмонофосфат-УМФ)
*моносахарид (пентоза), кот представлена либо рибозой (в сост РНК), либо дезоксирибозой (в сост ДНК)
Пентозу соед-ет с основанием N-гликозидная связь, обр-ая С1-атомом пентозы и N1-атомом пиримидина или N9-атомом пурина.
*остаток фосфорной к-ты. В завис-ти от числа увел: -нуклеозидмонофосфаты (НМФ), -нуклеозиддифосфаты (НДФ), -нуклеозидтрифасфаты (НТФ).
Нуклеиновые к-ты по своему строению – линейные полимеры. Остов имеет одинаковое строение по всей длине мол и сост из чеедующихся групп – «пентоза-фосфат-пентоза-…»
Первичная стр-ра ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи. Каждая фосфатная группа в полинукл-ой цепи за искл-ем фосфорного остатка на 5-конце мол участвует в обр-ии 2 эфирных связей с уч-ем 3- и 5- углеродных атомов 2 соседних дезоксирибоз, поэтму связь м-у мономерами обозначают 3,5-фосфодиэфирной.
Первичная стр-ра РНК-порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинукл цепи. Нукл связаны м-у собой 3,5-фосфодиэфирными связями. Концы цепей РНК неодинаковы: 1)фосфодилированная ОН-гр 5-углеродного атома; 2) ОН-гр 3-углеродного атома рибозы. Гидроксильная гр у 2 углеродного атома рибозы делает мол РНК нестабильной.
№37. Строение ДНК. Первичная стр-ра ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи. Каждая фосфатная группа в полинукл-ой цепи за искл-ем фосфорного остатка на 5-конце мол участвует в обр-ии 2 эфирных связей с уч-ем 3- и 5- углеродных атомов 2 соседних дезоксирибоз, поэтму связь м-у мономерами обозначают 3,5-фосфодиэфирной.
Вторичная стр-ра ДНК. 1953-Дж. Уотсон и Ф. Крик-модель пространств-ой стр-ры ДНК: мол ДНК имеет ф спирали, обр-ую 2 полинукл-ми цепями, закруч-ми относит-но др др и вокруг общей оси. Спираль правозакрюченная, полинукл-ые цепи в ней явл-ся антипаралл-ми => на каждом из концов мол ДНК расположена 5-конец одной цепи и 3-конец др цепи. Все основания цепей ДНК расп-ны внутри двойной спирали, а пентоофосфатный остов-снаружи. Полинукл-ые цепи удерж-ся относит-но др др за счет водородных связей м-у комплимент-ми пуриновыми и пиримидиновыми азот-ми основаниями А и Т (2) и м-у Г и Ц (3).
Правило Чаргаффа: число пуриновых оснований (А+Г)=числу пиримидиновых осн (Т+Ц). Комплемент-ые осн. уложены в стопку в сердцевине спирали. М-у осн-ми 2цепочной мол в стопке возникают гидрофобные взаи-ия, стабилизирующие двойную спираль. Такая стр-ра сключает контакт азотистых остатков с водой, но сопка оснований не м/б абсолютно вертикальной. Пара осн слегка смещены относит-но др др.
Третичная стр-ра ДНК. Каждая мол ДНК упакована в отд хромосому. В диплоидных Кл чел-ка содер-ся 46 хр. Все связ-ся с ДНК эукариотов б можно раздел на 2 гр: гистоновые, негистоновые. Комплекс б с ядерной ДНК наз-ют храматином.
№38. Первичная стр-ра РНК- порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклиотидой цепи. Нуклеотидысвязаны м/у собой 3,5-фосфодиэфирными связями. Концы цепей РНК неодинаковы: 1)фосфодилированная ОН-гр 5-углеродного атома;
2) ОН-гр 3-углеродного атома рибозы. Гидроксильная группа у 2’-углеродного атома рибозы делает молекулу РНК нестабильной.
Вторичная стр-ра РНК. Молекула построена из 1 полинуклиотидной цепи. Отдельнык участки цепи РНК образуют спирализованные петли, за счет водородныхсвязей м/у комплиментарными азотист основаниями. Участки цепи РНК в таких спиральных структурах антипаралельны, но не всегда полностью комплиментарны, в них встречаются неспаренные нуклеотидные остатки или даже 1 цепочечные петли, не висавшиеся в двойную спираль. Наличие спиральных уч-ков характерно д/всех типов РНК.
Третичная стр-ра. Возникает путем взаимодействия спирализ элементов вторичной стр-ры. Третичная структура РНК стабилизирована ионами двухвалентным Ме.
Типы РНК. тРНК. Универсальная модель «клеверного листа». В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей м/у нуклеотидными остатками. Участок ответственный за связывание с аминок-той на 3-конце молекулы и антикодон- специфич треплет нуклеотидов взаимодействующий комплиментарно с кадоном мРНК.
мРНК. Первичная стр-ра всех мРНК имеет одинаковое строение 5’- и 3’-концов. На 5-конце – модифицированный нуклеотид 7-метилгуанозин5-трифосфат (кэп). Несколько десятков нуклеотд отделяют кэп о инициирующего кодона, обычно это триплет АУГ. За кодирующим участком следует один из терминирующих каднов УГА, УУА, УАГ.
На 3-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аценозинмонофосфатных остатков. рРНК. Имеют многочисленные спирализованные участки. рРНК содержат несколько модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2-метилрибоза). рРНК образует комлексы с белками = рибосомы. Каждая рибосома состоит из 2 субединиц – малой и большой. Субединицы рибосом имеют разный набор РНК, кол-во и структуру белка.
39 .Переваривание нуклеопротеинов и всасывание продуктов их распада осуществляются в пищеварительном тракте. Под влиянием ферментов желудка, частично соляной кислоты, нуклеопротеины пищи распадаются на полипептиды и нуклеиновые кислоты; первые в кишечнике подвергаются гидролитическому расщеплению до свободных аминокислот. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы панкреатического сока. Продуктами реакции при действии РНКазы являются пуриновые и пи-римидиновые мононуклеотиды, смесь ди- и тринуклеотидов и резистентные к действию РНКазы олигонуклеотиды. В результате действия ДНКазы образуются в основном динуклеотиды, олигонуклеотиды и небольшое количество мононуклеотидов. Полный гидролиз нуклеиновых кислот до стадии мононуклеотидов осуществляется, очевидно, другими, менее изученными ферментами (фосфодиэстеразами) слизистой оболочки кишечника.В отношении дальнейшей судьбы мононуклеотидов существует два предположения. Считают, что мононуклеотиды в кишечнике под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизируют фосфоэфирную связь мононуклеотида («нуклеотидазное» действие), расщепляются с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Согласно второму предположению, мононуклеотиды всасываются, а распад их происходит в клетках слизистой оболочки кишечника. Имеются также доказательства существования в стенке кишечника нуклеотидаз, катализирующих гидролитический распад моно-нуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой оболочки преимущественно фосфороли-тическим, а не гидролитическим путем.Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Другие основания в тканях могут включаться в состав нуклеиновых кислот. Таким образом, синтез нуклеиновых кислот, мономерными единицами которых являются мононуклеотиды, будет определяться скоростью синтеза пуриновых и пиримидиновых нуклеотидов; синтез последних в свою очередь зависит от наличия всех составл40 Механизм синтеза пиримидиновых нуклеотидов почти полностью расшифрован благодаря исследованиям П. Рейхарда. Показано, что в клетках животных и в микроорганизмах конечными продуктами синтеза также не являются свободные пиримидиновые основания и остаток рибозы присоединяется к уже сформировавшемуся пиримидиновому кольцу. Синтез начинается с элементарных уровней (СО2, NH3, аспартат), и специфическую ключевую роль выполняет оротовая кислота.I стадия синтеза УМФ включает катализируемое цито-плазматической карбамоилфосфатсинтетазой образование карбамоилфос-фата из глутамина. На II стадии карбамоилфосфат реагирует с аспартатом, в результате чего образуется N-карбамоиласпарагиновая кислота. Последняя подвергается циклизации (под действием дигидрооротазы) с отщеплением молекулы воды, при этом образуется дигидрооротовая кислота, которая, подвергаясь дегидрированию, превращается в оротовую кислоту. В этой реакции участвует специфический НАД-содержащий фермент дигидро-оротатдегидрогеназа. Оротовая кислота обратимо реагирует с ФРПФ, являющимся донатором рибозо-фосфата, с образованием оротидин-5'-фос-фата (ОМФ). Декарбоксилирование последнего приводит к образованию первого пиримидинового нуклеотида – уридин-5-фосфата (УМФ). Превращение УМФ в УДФ и УТФ осуществляется, как и пуриновых нуклеотидов, путем фосфотрансферазных реакций: УМФ + АТФ <=> УДФ + АДФ ; УДФ + АТФ <=> УТФ + АДФ.
40) Биосинтез пуриновых и пиримидиновых.
Синтез начинается с образования 5-фосфорибозил-1 -амина из рибозо-5-фосфат (АТФ-АМФ) получается 5-фосфорибозил- 1-дифосфат (гпутамин-глутомат\Н4Р2О7) 5-фосфорибозиламин.
затем к аминогруппе присоединяется остаток глицина и далее ; последовательно протекают реакции ооразования пуринового ядра с использованием метешгаьной группы метенил-Н4фолата, еще одной амидной группы пгутамина, диоксида углерод , аминогруппы аспарагиновой кислоты, формнльного остатка формил-Н4-фолата. Результатом этой серии реакций является образование инозиновой кислоты (ИМФ).
Инозиновая кислота - это нуклеотид, пуриновая часть которого представлена гипоксантином: она встречается
в составе тРНК в качестве одного из минорных нуклеотидов. Кроме того, инозиновая кислота служит предшественником основных пуриновых нукпеотидов - АМФ и ГМФ, схема синтеза которых представлена . При действии специфических киназ эти нуклеозидмонофосфаты превращаются в нуюгеозиддифосфаты и нуклеозидтрифосфаты.Следуюшим образом а)инозиновая к-та ( аспартат/ ГТФ-ГДФ+ НЗРО4) аленилоянтарная к-та (-фумарат) адениловая к-та (АТФ-АДФ) АДФ-АТФ б) инозиновая к-та (НЮ/ НАД+-НАДН+Н+) ксантиловая к-та (Н2О/ глутомин -глутомат, АТФ-АМФ+Н4Р2О7 ) гуаниловая к-та (АТФ-АДФ) ГДФ (АТФ-АДФ ) ГТФ.
Пиримидиновое ядро пиримидиновых пуклеогидов образуется из диоксида углерода, амидной группы глутамина, аспарагиновой кислоты. В результате цепи реакций из этих веществ синтезируется уридинмонофосфорная кислота, которая в свою очередь служит предшественником других пиримидиновых нуклеотидов — цитидиловых и тимидиловых.
Биосинтез уридиловон кислоты. Первая реакция пути синтеза УМФ — это образование карбамоилфосфата при действии кар бамоилфосфатсинтетазы II (точнее, при действии карбамоилфосфатсинтетазного активного центра 1юлиф>нкцнон!ии>жмх> фермеша). Б зтой реакции ЫН2-1рушш кароамиилфисфт'а образуется за счет амидной lyyjuibj пгутамина:
СО2 + Глутамин + 2АТФ + Н2О-» H2N-CO-OPO3H2 + Глутамат + 2АДФ + НЗРО4
Напомним, что при синтезе мочевины в реакции, катализируемой карбамоилфосфатсинтетазой 1, используется аммиак, а не глутамин. Эти ферменты различаются также локализацией:
карбамоилфосфатсинтетаза 1 содержится в митохондриях, главным образом в печени, а карбамоилфосфатсинтетаза II—в цитозоле, практически во всех клетках организма.
Далее карбамоилфосфат в реакции с аспарагиновой кислотой образует карбамоиласпарагиновую кислоту, которая денатурируется с образованием пиримидинового цикла дигидрооротовой кислоты:
Первые три реакции—образование карбамоилфосфата, карбамоиласпартата и дигидрооротовой кислоты— катализируются одним белком, содержащим активные центры для катализа каждой из реакций, Карбамоилфосфат и карбамоиласпартат не освобождаются из фермент-субстратного комплекса; освобождающимся продуктом действия
этого белка является дигидрооротовая кислота, Следовательно, Карбамоилфосфат, образующийся при синтезе УМФ,
не может быть использован для синтеза мочевины.
Дигидрооротовая кислота при действии отдельного фермента (дегидрогеназы) превращается в оротовую кислоту. Две следующие реакции—образование оротидиловой кислоты и ее декарбоксилирование—катализируются также одним белком. Таким образом, шесть активных каталитических центров, необходимых для синтеза пиримидиновых нуклеотидов, кодируются только тремя структурными генами.
Биосинтез цитидиловых иуклеотндов. Из УМФ при действии специфических киназ образуются УДФ и УТФ: УМФ + АТФ -» УДФ + АДФ УДФ + АТФ -> УТФ + АДФ Путем аминирования УТФ образуется цнтидинтрифосфорная кислота, в этой
Более сложным путем из уридиловой кислоты (а также из цитидиловой кислоты) образуются тимидиловые нуклеотиды.
Синтез УМФ регулируется по механизму отрицательной обратной связи: УТФ является аллостерическим ингибитором первого фермента этой метаболической цепи — карбамоилфосфат-синтетазы II. Этот механизм предотвращает избыточный синтез не только УМФ, но и всех других пиримидиновых нуклеотидов, поскольку они образуются из УМФ.
41 Катаболизм пуриновых нуклеотидов приводит к образованию ксантина, который в организме человека превращается в мочевую кислоту. Часть свободных пуриновых оснований используется повторно (реутилизация) под действием ферментов гипоксантин-гуанин-фосфорибозиттрансферазы и аденинфосфорибозилтрансферазы, которые превращают пуриновые основания в нуклеотиды. Донором фосфорибозильной группы служит 5’-фосфорибозил-1’-пирофосфат (PRPP). Гиперурикемия - состояние, проявляющееся повышением содержания мочевой кислоты в крови. Причинами гиперурикемии может быть: - избыточный синтез мочевой кислоты вследствие нарушения регуляции -снижение в плазме концентрации уратсвязывающего белка - транспортного белка для мочевой кислоты -замедление выведения мочевой кислоты с мочой -снижение скорости реутилизации пуриновых оснований. Подагра - заболевание, причиной которого является гиперурикемия. Так как мочевая кислота плохо растворимое соединение, то при повышении концентрации происходит ее кристаллизация и накопление в суставах под кожей или в виде почечных камней. Способом, снижающим синтез мочевой кислоты, является применение в качестве лекарства аллопуринола - конкурентного ингибитора ксантиноксидазы, фермента, катализирующего превращение гипоксантина в ксантин и ксантина в мочевую кислоту. В результате катаболизм нуклеотидов приводит к образованию гипоксантина, который является более растворимым веществом. Синдром Леша-Нихана - генетическое заболевание, связанное с повышением у детей синтеза мочевой кислоты и, как следствие этого, развитием различных нейрофизиологических нарушений: замедлению умственного развития, агрессивности и т.д. Причиной этого является дефект фермента гипоксантин-гуанин-фосфорибозил-трансферазы , который катализирует реутилизацию гуанина и гипоксантина. В этом случае образуется больше ксантина и, следовательно, мочевой кислоты. Кроме того, снижение синтеза GMP и IMP из свободных оснований ухудшает регуляцию скорости их синтеза из мелких фрагментов путем реутилизации.
Катаболизм пиримидиновых нуклеотидов приводит к образованию пиримидиновых оснований, а затем протекает разными путями в зависимости от вида организма. У человека конечными продуктами распада являются СО2, NН3, -аланин (из урацила) и -иминомасляная кислота из тимина. Ферменты реутилизации свободных пиримидиновых оснований не были обнаружены, но клетки млекопитающих обладают способностью реутилизировать пиримидиновые рибонуклеозиды - уридин и цитидин, превращая их в соответствующие нуклеотиды.
Реутилизация пуриновых оснований
Свободные пуриновые и пиримиди-новые основания непрерывно образуются в клетках в результате описанного выше метаболического распада нуклеотидов. Значительная часть этих свободных пуриновых оснований не подвергается дальнейшему распаду, а реутилизирует-ся, т.е. используется вновь для синтеза пуриновых нуклеотидов. В этом случае нуклеотиды образуются совсем не так. как при биосинтезе de novo, который мы рассмотрели выше. Пуриновое ядро аденина, синтезирующееся de novo, строится на рибозо-5-фосфате этап за этапом, в длинной последовательности реакций. Путь биосинтеза из готовых продуктов гораздо проще. Он включает всего лишь одну реакцию, в ходе которой свободный аденин взаимодействует с 5-фосфорибозил-1-пирофосфатом
(ФРПФ), что и приводит к образованию аденинового нуклеотида
Аденин + ФРПФ -»• AMP + РР,.
Свободный гуанин реутилизируется тем же путем при помощи другого фермента
Гуанин + ФРПФ — GMP + РР;.
42 Биосинтез белка проходит в 4 этапа: 1 этап. Транскрипция – передача информации о структуре белка из молекулы ДНК для и-рнк. Этот дело осуществляется с участием специальных ферментов и происходит так: двойной ряд в определенном отрезке разъединяется и вдоль одной из цепей ДНК начинается синтез молекулы и-рнк сообразно принципу комплементарности. Определен отруб ДНК (ген) матрицей для соответствующей и-рнк. Слайсинг – из новообразованной и-рнк вырезаются неинформационные фрагменты – интроны и сшиваются информационные участки – экзоны. Екзоны – последовательность нуклеотидив в генах, которые кодируют синтез белка (информативный участок). Интроны – последовательность нуклеотидив ДНК, которые не кодируют синтез белка (неинформативный участок). Сплайсеры – отрезок ДНК, который не несет генетическую информацию. Синтезированые молекулы и-рнк переходят из ядра в цитоплазму, а ДНК возобновляет свою структуру.
ІІ этап. Активация аминокислот. Этот дело происходит в цитоплазме. Активированые молекулы аминокислот соединяются с молекулами транспортных РНК, каждой из 20 аминокислот отвечает определенная т-рнк. В молекуле т-рнк есть два важных участка: к одной из них прикрепляется соответствующая аминокислота, а другая содержит триплет нуклеотидив, который отвечает коду данной аминокислоты в молекуле и-рнк. Активированы еаминокислоты, соединенные из т-рнк поступают к рибосомам.
ІІІ этап. Трансляция – синтез полипептидних цепей. Происходит так: молекула и-рнк двигается между двумя субединицами рибосом и к ней последовательно присоединяются молекулы т-рнк с аминокислотами. При этом сообразно принципу комплементарности кодоны и-рнк вступают в взамодействие с антикодонами т-рнк. Последовательность расположения аминокислот определяется последовательностью триплетов в молекуле и-рнк. Аминокислоты образуют пептидные связки впоследствии энергии АТФ и в результате из рибосоми всходит полипептидная цепь.ІV этап. Терминация – процесс образования вторичной и третичной структур белковой молекулы. Этот этап осуществляется в цитоплазме путем скручивания, свертывания полипептидов. Молекулярные болезни - понятие ввёл американский химик и физик Лайнус Карл Полинг, (Pauling Linus Carl, род. в 1901 г.).
Обозначает болезни, вызываемые нарушением синтеза того или иного белка или образованием функционально неполноценных белков вследствие нарушения последовательности аминокислот в полипептидной цепи.
43 Процесс образования молекулы мРНК на матрице ДНК – биогенез мРНК – в прокариотических клетках представляется относительно простым и включает главным образом транскрипцию соответствующего гена при участии РНК-полимеразы. Во многих случаях первичным продуктом экспрессии гена является молекула мРНК, уже способная к функционированию, т.е. у прокариот транскрипция и трансляция являются сопряженными процессами. Биосинтез тРНК у прокариот из первичного тРНК транскрипта проходит стадию процессинга аналогично синтезу мРНК и тРНК у эука-риот. Биогенез мРНК у эукариот существенно отличается не только механизмом регуляции транскрипции, но и многоступенчатостью формирования активной молекулы. До открытия феномена сплайсинга мРНК было известно, что многие мРНК эукариот синтезируются в виде гигантских высокомолекулярных предшественников (пре-мРНК), которые уже в ядре подвергаются посттранскрипционному процессингу. Предполагали, что процессинг включает удаление длинных 5'- и 3'-концевых участков, которые якобы выполняют регуляторные функции. Как оказалось, ген эукариот является не непрерывной, а мозаичной структурой, содержащей наряду с кодирующими (экзоны) также некодирующие (интроны) последовательности. Фермент РНК-полимераза катализирует транскрипцию как экзонов, так и интронов с образованием гетерогенной ядерной РНК (гяРНК), называемой также первичным транскриптом. Термин «интроны» означает вставочные, нетранслирующие последовательности нуклеотидов в ДНК эукариот. Этот термин применим и к вставочным нуклеотидным последовательностям первичного РНК-транскрипта. С открытием интрон-экзонного строения генов, характерного для эукариотических клеток, начался новый этап исследований на пути реализации генетической информации. Транскрипция гена, состоящего из чередующихся кодирующих и некодирующих нуклеотидных последовательностей, обеспечивала полное его копирование и приводила к синтезу РНК-предшественника. Поэтому было высказано предположение о существовании между транскрипцией и трансляцией еще одного важного звена – образования пригодной для трансляции «зрелой» молекулы мРНК. Этот этап получил название процессинга, или созревания, мРНК. К настоящему времени считается установленным, что процессинг мРНК включает три основных процесса: 1) кэпирование – химическая модификация 5'-концевой последовательности мРНК; 2) сплайсинг – удаление некодирующих интронных последовательностей из мРНК и сшивание образующихся экзонов; 3) полиаденилирование – химическая модификация 3'-концевой последовательности мРНК. В осуществлении каждого из указанных процесов специфическое участие принимает ряд белков и нуклеиновых кислот, хотя конкретные молекулярные механизмы этих превращений еще не полностью раскрыты. Все три указанных процесса имеют важное значение в формировании зрелой молекулы мРНК. Однако наибольший интерес исследователи проявляют к выяснению молекулярного механизма сплайсинга, который должен обеспечить, во-первых, постепенное и высокоточное вырезание интронов из первичного транскрипта и, во-вторых, сшивание образующихся фрагментов – экзонов – «конец в конец». Любые отклонения или смещения границ в процессе вырезания интронов и сшивания экзонов даже на один нуклеотид могут привести не только к глубокому искажению смысла в кодирующих последовательностях, но и к нарушению передачи генетической информации и развитию патологии. Последовательность нуклеотидов в молекуле мРНК обычно начинается с пары 5'-ГУ и заканчивается парой АГ-3'. Эти последовательности, вероятнее всего, служат сайтами (местами) узнавания для ферментов сплайсинга. Поскольку 5'-ГУ ... АГ-3' последовательности не открыты в молекулах предшественников тРНК, было высказано предположение о существовании по меньшей мере двух типов ферментов сплайсинга; одного для мРНК и другого для тРНК. Имеются, кроме того, достоверные данные о том, что интроны часто оказываются длиннее экзонов и что внутри гена на интроны приходится значительно большая часть нуклеотид-ных пар. Подсчитано, например, что ген овальбумина содержит 7 интронов, в общей сложности насчитывающих 7700 пар оснований, в то время как сформировавшаяся после сплайсинга мРНК насчитывает всего 1859 оснований. Почти во всех эукариотических клетках синтезированные на структурных генах первичные транскрипты подвергаются процессингу, прежде чем выполнят свои уникальные функции в белковом синтезе. Во многих случаях процессинг имеет место главным образом в ядре, хотя этот процесс продолжается и после транспортировки молекул РНК из ядра в цитоплазму: например, терминальные реакции полиаденилирования и метилирования остатков нуклеозидов. Химический смысл кэпирования сводится к присоединению остатка 7-метилгуанозина посредством трифосфатной группы к 5'-концу молекулы транскрипта, метилированию 2'-ОН-группы первого и второго нуклеотидов на 5'-конце мРНК. Полиаденилирование 3'-конца первичного транскрипта включает ряд стадий и участие эндонуклеазы и полиаденилатполимеразы. Эндонуклеаза расщепляет мРНК вблизи специфической сигнальной последовательности (5')ААУААА(3'), отличающейся высокой консервативностью. Полиаденилатполимераза синтезирует поли-А-конец (от 20 до 250 нуклеотидов) начиная с точки распада. Функции 5'-кэп и 3'-поли-А раскрыты недостаточно полно. Показано, что 5'-кэп, соединяясь со специфическим белком, принимает участие в связывании мРНК с рибосомой, способствуя инициации синтеза белка. Допускают, что основное назначение 5'-кэп и поли-А – защита мРНК от энзиматического распада. Известно также, что не все цитоплазматические мРНК содержат участки поли-А на 3'-концах и что в цитоплазме клеток животных происходит как присоединение, так и удаление участка поли-А из молекулы мРНК. Следует отметить, что размер молекулы цитоплазма-тической мРНК даже после удаления 3'-поли-А оказывается все же намного большим, чем требуется для синтеза кодируемого белка. В частности, размер мРНК белка глобина (эритроциты кролика) составляет 550 нуклео-тидов, в то же время кодирующий участок состоит из 430 нуклеотидов (размер поли-А – 40 нуклеотидов). Другой пример: размер мРНК тяжелого иммуноглобулина (из клеток миеломы мышей) составляет 1800 нуклеотид-ных остатков, а кодирующая часть – 1350 нуклеотидов (размер поли-А – 150–200 нуклеотидов). Интересно, что большинство указанных процессов, если не все, могут регулироваться независимо, изменяя уровень экспрессии гена. Более того, даже после завершения формирования мРНК изменения ее стабильности могут оказывать существенное влияние на экспрессию гена. В последние годы интенсивно исследуются структура и назначение нетранслируемых участков генов – интронов. Они различаются по числу, размерам и топографии. Показано, например, что ген сывороточного альбумина хотя и содержит всего 6 интронов, но на их долю приходится до 80% этого гена; интроны имеют размеры от 90 до 20000 нуклеотидных пар. Ген коллагена содержит более 50 интронов. Исключение составляют лишь гены, кодирующие гистоны, не содержащие интронных структур. Различают 4 класса интронов. Первый класс открыт как в ядерных, так и в митохондриальных генах, кодирующих рибосомные рРНК; второй класс интронов открыт в первичных транскриптах митохондриальных матричных мРНК. Оказалось, что оба эти класса интронов не нуждаются ни в источнике энергии, ни в участии ферментов, но наделены способностью самосплайсинга. Третий – самый большой класс интронов обнаружен в первичных транскриптах ядерных мРНК, подвергающихся созреванию. Сплайсинг требует наличия комплекса белков и особой группы клеточных РНК, названных малыми ядерными РНК (мяРНК). Выделено и охарактеризовано 5 групп богатых уридином мяРНК, соответственно обозначаемых U1, U2, U4, U5 и U6, размерами от 100 до 200 нуклеотидов. Комплексы мяРНК и белков, названные малыми ядерными нуклеопро-теинами, объединяются в единую систему – сплайсосому, координирующую весь процесс сплайсинга. Предполагают, что мяРНК соединяются с обеими концами интрона, способствуя формированию специфической конформации, необходимой для узнавания ее участвующими в процессе ферментами, сближению двух экзонов, удалению интронов и воссоединению кодирующих экзонов. Четвертый класс интронов открыт в ряде тРНК. Сплайсинг этой группы интронов требует доставки энергии и присутствия эндонуклеаз и лигаз, катализирующих соответственно разрыв фосфодиэфирных связей с 5'- и 3'-концов интрона и соединяющих два экзона. В нетранскрибируемых последовательностях генома перед экзон-интронами открыты специфические участки, названные промоторами, а также энхансерами (повышающие уровень транскрипции) и силан-серами (ослабляющие уровень транскрипции). При взаимодействии с белками они выполняют функции регуляторных сигналов при транскрипции. Этот способ регуляции широко используется клетками эукариот как в процессах дифференцировки, так и при индукции репрессии.
44 .Репарация — особая функция клеток , заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК , повреждённой при нормальном биосинтезе ДНК в клетке или в результате воздействия физическими или химическими агентами. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации. Устройство системы репарации: - фермент , "узнающий" химически изменённые участки в цепи ДНК и осуществляющий разрыв цепи вблизи от повреждения - фермент , удаляющий повреждённый участок
- фермент ( ДНК-полимераза ), синтезирующий соответствующий участок цепи ДНК взамен удалённого - фермент ( ДНК-лигаза ), замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность
Типы репарации








