Масса веществ, участвующих в реакции, равна массе продуктов реакции .
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис.). Масса исходных веществ всегда равна массе продуктов реакции
3. Сущность закона сохранения массы
Современная формулировка закона:
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
Закон сохранения массы веществ является основой составления химических уравнений
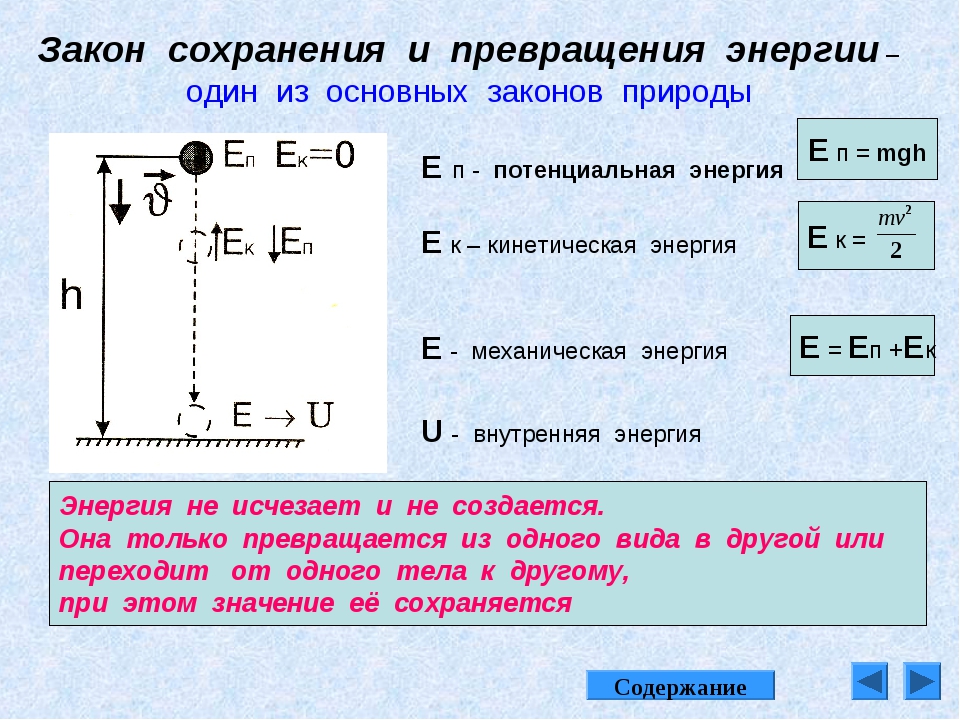
4. Закон сохранения энергии в химических реакциях
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии. Он рассматривал эти законы в единстве. В 1905 г. А. Эйнштейн установил взаимосвязь массы и энергии. Взгляды Ломоносова подтверждены современной наукой. Закон сохранения энергии действует во всех случаях и повсюду, где одна форма энергии переходит в другую.
Закон сохранения энергии:
Количество тепловой энергии, принесённой в зону взаимодействия веществ равно количеству энергии, вынесенной веществами из этой зоны.

5.Выводы:
Где и как мы будем применять данный закон?
в химическом производстве
при составлении уравнений
в расчетах при решении задач
Значение закона (записываем в тетради). Произошел переворот в науке химии, теперь наука могла объяснять изменения веществ
Вещества не исчезают бесследно и не образуются из ничего.
Сущность химических явлений заключается в перераспределении атомов исходных веществ с образованием новых веществ.
Позволяет составлять уравнения реакций и производить расчеты.
V .Закрепление. Обобщение и систематизация полученных знаний.
1.Самостоятельная работа
1. Закончите предложения:
а) Закон сохранения массы веществ экспериментально подтвердили: ____М_________________________ и ______________________________ .
б) Современная формулировка закона сохранения массы веществ такая: __________________________________________________________________.
в) Закон сохранения массы веществ используют для составления _____________________________ и _______________________________.
г) Число атомов до реакции всегда должно равняться ______________________________________________________________.
д) Коэффициент всегда ставится ________________________________.
2. Фронтальный опрос
- Какую тему мы изучили сегодня на уроке?
- Кем был открыл закон сохранения массы веществ?
- Какое значение имеет закон сохранения массы веществ и где применяется?
- Какое следствие вытекает из закона сохранения массы веществ?
- В чём суть химической реакции?
- Что называют коэффициентом и для чего его применяют в уравнениях химических реакций?
VI . Рефлексия.
- Так какой смысл, по-вашему, мнению, вложил Ф. Бекон в выражение: «Истина – дочь времени, а не авторитета»?
- Как химики познают мир веществ?








