Тема 10. Важнейшие химические понятия и законы
Тема 10. Важнейшие химические понятия и законы
Урок № 10.2 Законы сохранения массы в и энергии в химии.
Цел и урока:
Образовательные.
Ознакомить учащихся с законом сохранения массы веществ; объяснить на его основе положение атомно-молекулярного учения о сохранении атомов при химических превращениях.
Экспериментально доказать закон сохранения массы веществ.
Познакомить учащихся с исторической справкой - открытия закона сохранения массы веществ. Показать значение открытия закона.
Развивающие.
Способствовать развитию навыков самостоятельной и групповой работы; развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку;
способствовать развитию познавательной активности учащихся (мотивированный интерес к учёбе);
развивать логическое мышление учащихся, наблюдательность, умение устанавливать причинно-следственные связи, сравнивать, обобщать и делать выводы;
развивать умение применять закон сохранения массы веществ для решения расчётных задач;
Воспитательные.
Формировать у учащихся понятие о единстве всего мира; прививать интерес к изучаемой теме, предмету.
Ф ормировать УУД:
Познавательные УУД : умение осуществлять поиск нужной информации, выделять главное в тексте, структурировать учебный материал, грамотно формулировать вопросы,
Личностные УУД : умение применять полученные знания в своей практической деятельности.
Регулятивные УУД: умение планировать свою работу при выполнении заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД:умение работать в составе творческих групп, высказывать свое мнение.
Оборудование: портреты учёных, презентация.
ХОД УРОКА
I. Организация учащихся к уроку.
II. Мотивация.
«Знания, не проверенные опытом,
матерью всякой достоверности,
бесплодны и полны ошибок»
Леонардо да Винчи
III . Актуализация опорных знаний.
1. Определить явления.
Предлагаю учащимся прослушать отрывки из художественных произведений с целью выяснить, о каком явлении идет речь. Привожу примеры отрывков, тем самым проверяю знание химических и физических явлений, индекс, коэффициент, уравнение химической реакции, химическая формула, признаки и условия химических реакций
| 1.Люблю грозу в начале мая, Когда весенний первый гром, Как бы резвяся и играя, Грохочет в небе голубом. Ф. И. Тютчев. Весенняя гроза | 2. Последняя туча рассеянной бури! Одна ты несешься по ясной лазури, Одна ты наводишь унылую тень, Одна ты печалишь ликующий день. А. С. Пушкин. Туча |
| 3. Мой костер в тумане светит: Искры гаснут на лету... Я. П. Полонский. Песни цыганки | 4. Шалун уж заморозил пальчик, Ему и больно и смешно, А мать грозит ему в окно... А. С. Пушкин. Евгений Онегин |
| 5. Вот уж вечер. Роса блестит на крапиве. Я стою у дороги, Прислонившись к иве. С. А. Есенин. Вот уже вечер. Роса... | 6. Мело, мело по всей земле Во все пределы. Свеча горела на столе, Свеча горела. Б.Пастернак |
2.Фронтальный опрос
1.Что называется химической реакцией?
2.Какие вы знаете признаки химических реакций?
3. По каким признакам можно судить о том, что произошла химическая реакция?
(Химические реакции сопровождаются внешними эффектами: изменение цвета , в ыделение газа , о бразование или исчезновение осадка , п оявление или исчезновение запаха , выделение или поглощение теплоты, появление пламени, иногда – свечение, излучение света, возникновение электричества)
4. К ак обознача ют состав вещества?
(с помощью хим. формул Химическая формула – это условная запись состава вещества с помощью хим. знаков и индексов. )
5.А как вы думаете, происходят ли с веществами количественные изменения, например, что происходит с массой веществ?
6.Какие будут мнения?
7.Мнения разделись. Кто же из вас прав?
8. Какова будет тема урока? (Что происходит с массой веществ при химических реакциях?)
9.Как мы это можем выяснить?
10.(Провести опыт, прочитать в учебнике).
I V .Изучение нового материала
1. Сущность химической реакции с позиции атомно-молекулярной теории
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
В соответствие с атомно-молекулярной теорией, вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:
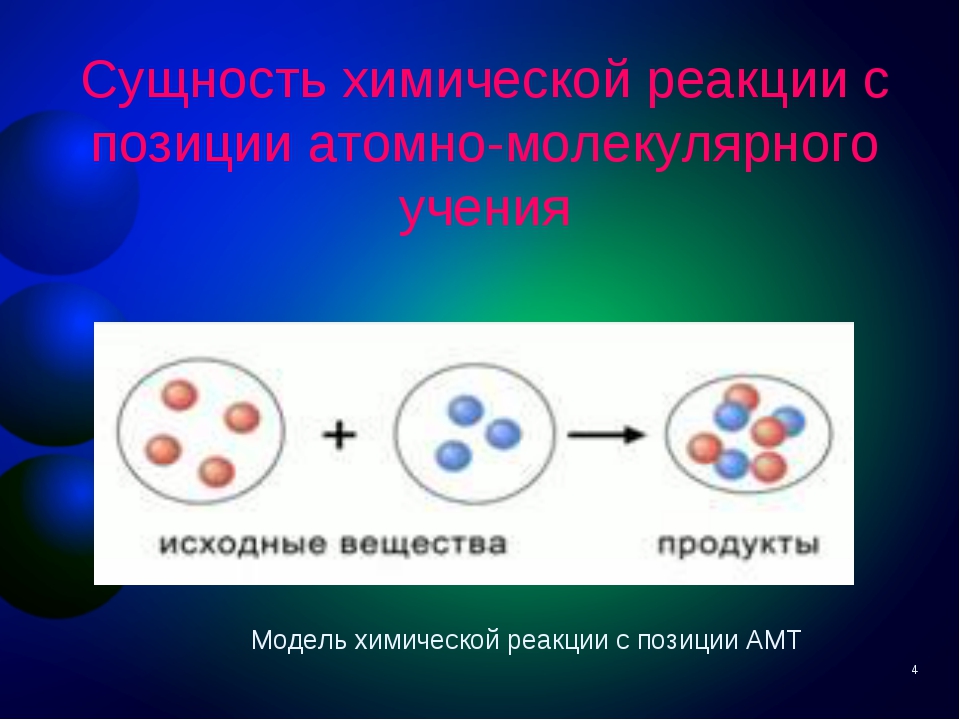
Проанализировав данную модель, мы можем выдвинуть гипотезу (научно обоснованное предположение):
Суммарная масса продуктов реакции должна быть равна суммарной массе исходных веществ.
2. История открытия закона.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
А) Открытие Р. Бойля
Экспериментальный метод в химии начал широко использоваться после исследований
Р. Бойля в 17веке. В 167 3 году английский ученый Роберт Бойль провёл опыт: он взвесил запаянную реторту с порошком металла, длительное время нагревал её, потом охладил до комнатной температуры, вскрыл реторту и снова взвесил. Вес реторты с содержимым увеличился.
Вот что записал учёный после одного из своих опытов:
«После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух. По нашему наблюдению при этой операции была значительная прибыль в весе …»
На основании чего Р. Бойль делает вывод, что масса прокалённого металла увеличивается за счёт соединения металла с «огненной силой», которая проникает через стенки реторты. Такие частицы «огненной силы» в то время называли флогистонами. (считал, что через стенки сосуда проникал «флогистон»)








