Коллоидные системы
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
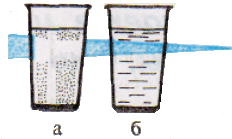
Пропускание луча света через растворы;
а – истинный раствор хлорида натрия;
б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO32-, которых в растворе много вследствие диссоциации силиката натрия:
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт “Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
Контрольные вопросы:
1. Охарактеризуйте понятие «дисперсная система». Чем дисперсная система отличается от других смесей?
2. Какие типы дисперсных систем в зависимости от агрегатного состояния среды и фазы вы знаете? Приведите примеры
3. Какие системы называются грубодисперсными?
4. Какие системы называются тонкодисперсными?
5. Что такое гели, золи?
Используемая литература:
1. Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
2. Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с.








