Лабораторная работа. Тема: „Зависимость скорости химической реакции от концентрации реагирующих веществ”.
Химическая реакция протекает по уравнению: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S + SO 2 + H 2 O
Как видно из уравнения реакции, разложение тиосульфата в кислой среде сопровождается выделением серы (раствор мутнеет) и выделением газа (специфический запах). Время от начала опыта до достижения определенной степени помутнения раствора можно принять за время прохождения реакции.
Ход работы:
1. В три стаканчика налить раствор тиосульфата натрия и дистиллированную воду, в количествах, указанных в таблице ниже.
2. В каждый из стаканчиков добавить при помешивании раствор серной кислоты. В каждом случае зафиксировать время от начала добавления серной кислоты до появления мутности, результаты отразить в таблице.
| № опыта | V (Na2S2O3) мл | V (H2O) мл | V (H2SO4) мл | Время появления мутности (с) | Скорость ( 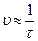 ), c-1 ), c-1
|
| 1. | 5 | 10 | 5 | ||
| 2. | 10 | 5 | 5 | ||
| 3. | 15 | 0 | 5 |
3. Сделать вывод о влиянии концентрации Na2S2O3 на скорость реакции. Предположить порядок данной реакции по тиосульфату натрия.
Вывод:
Порядок реакции по тиосульфату натрия:
| № опыта | V (H2SO4) мл | V (H2O) мл | V (Na2S2O3) мл | Время появления мутности (с) | Скорость ( 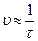 ), c-1 ), c-1
|
| 1. | 5 | 10 | 5 | ||
| 2. | 10 | 5 | 5 | ||
| 3. | 15 | 0 | 5 |
4. В три стаканчика налить раствор серной кислоты и дистиллированную воду, в количествах, указанных в таблице ниже.
5. В каждый из стаканчиков добавить при помешивании раствор тиосульфата натрия. В каждом случае зафиксировать время от начала добавления Na 2 S 2 O 3 до появления мутности, результаты отразить в таблице.
6. Сделать вывод о влиянии концентрации серной кислоты на скорость реакции. Предположить порядок данной реакции по серной кислоте.
Вывод:
Порядок реакции по серной кислоте:
Лабораторная работа. Тема: «Влияние температуры и концентрации веществ на смещение химического равновесия».
Опыт №1. Влияние концентрации на смещение химического равновесия.
На примере реакции между FeCl3 и KSCN рассмотрим действие концентрации на смещение химического равновесия:
FeCl 3 (желт.) + 3 KSCN (бесцв.) ↔ Fe ( SCN )3(красн.) + 3 K С l (бесцв.)
Ход работы:
1. В химический стакан налить 5 мл раствора FeCl3 (С = 0,02 моль/л) и 5 мл раствора KSCN (С = 0,02 моль/л). Отметить образование раствора кроваво-красного цвета.
2. Разлить полученный раствор на 4 пробирки. Первая пробирка – эталон окраски.
3. Во вторую добавить 3-4 капли насыщенного раствора KSCN и перемешать.
4. В третью добавить 3-5 капель насыщенного раствора FeCl3.
5. В четвёртую добавить на шпателе небольшое количество кристаллического KСl.
6. Отметить изменение окраски в каждой пробирке по сравнению с эталоном.
7. Результаты опыта представить в виде таблицы.
| № пробирки | Добавленное вещество | Наблюдение | Выводы |
| 1 | - | эталон | - |
| 2 | KSCN | ||
| 3 | FeCl3 | ||
| 4 | KCl |
Опыт №2. Влияние температуры на смещения химического равновесия.
Для опыта воспользуемся реакцией образования йодкрахмала:
I2 + крахмал ↔ йодкрахмал ∆ H<0
Ход работы:
1. В две пробирки налить по 4 мл раствора крахмала и по 2 капли раствора йода, перемешать, отметить изменение окраски. Первая пробирка – контрольная.
2. Вторую пробирку нагреть над пламенем горелки. Наблюдать эффект.
3. Охладить пробирку с раствором. Наблюдать эффект.
4. Как изменяется окраска раствора в нагретой пробирке по сравнению с холодной?
___________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. На основе полученных результатов наблюдений сделать вывод о смещении химического равновесия под влиянием изменения температуры в соответствии с принципом Ле-Шателье.
Вывод:








