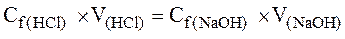Лабораторная работа . Тема : “Физико-химические методы исследования растворов. Приготовление растворов”.
Ход работы:
1. Приготовить водные растворы NaCI (2%), NaCl (4%) массой 250 г.
2. С помощью ареометра определить плотность полученных растворов.
3. С помощью рефрактометра определить показатель преломления полученных растворов.
4. Записать данные в таблицу. Сравнить полученные данные со справочными данными для этих растворов.
| Раствор | W% | ρ, г/мл | ρ, г/мл (справоч.) | n | n (справоч.) |
| Н2О | - | ||||
| NaCI | 2 | ||||
| NaCI | 4 |
5. Освоить практические навыки определения основных физико-химических характеристик растворов: плотности, показателя преломления.
6. Для полученных растворов рассчитать: молярную концентрацию, моляльную концентрацию. Ответ оформить в виде таблицы.
| Раствор | W% | С, моль\л | Сm, моль\кг |
| NaCI | 2 | ||
| NaCI | 4 |
Вывод:
Лабораторная работа. Тема: «Определение молярной концентрации эквивалента раствора соляной кислоты методом алкалиметрии».
Ход работы:
| 1. | Бюретку заполнить рабочим раствором гидроксида натрия (Сf = 0,1 н) до нулевого деления. | |||||||||||||
| 2. | Пипеткой отмерить точный объем - 10 мл раствора соляной кислоты неизвестной концентрации и перенести в колбу для титрования. | |||||||||||||
| 3. | В раствор кислоты добавить 2-3 капли индикатора - фенолфталеина, содержимое перемешать. | |||||||||||||
| 4. | Титровать раствор кислоты рабочим раствором щелочи, медленно, по каплям, постоянно перемешивая, до появления устойчивой розовой (малиновой) окраски, которая свидетельствует об окончании титрования – достижении точки эквивалентности. |
| ||||||||||||
| 5. | Определить по делениям на бюретке точный объем рабочего раствора, который был израсходован на титрование. | |||||||||||||
| 6. | Титрование провести трижды (перед каждым титрованием нужно обязательно установить уровень жидкости в бюретке на нулевое деление шкалы). По окончании работы титрант из бюретки слить, а бюретку промыть дистиллированной водой. | |||||||||||||
| 7. | Рассчитать средний объем рабочего раствора из трех опытов (допустимое расхождение 0,2 мл):
| |||||||||||||
| 8. | Произвести расчет и определить молярную концентрацию эквивалента кислоты:
| |||||||||||||
Вывод: