Тема 16. Неметаллы
Урок № 16.5. Кислородсодержащие кислоты, образуемые элементами подгруппы азота.
Урок № 16.6. Химические свойства кислотных оксидов.
В химии и технологии широко применяют кислородсодержащие кислоты азота — азотистую и азотную и их соли.
Азотистая кислота HNOz в свободном виде не получена, существует в водном растворе. Кислота средней силы (К& 5-10-4).
Химические свойства
1. При кипячении разлагается (реакция диспропорционирования):

При пониженной температуре существует равновесие:

2. Взаимодействует со щелочами: 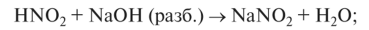
гидроксидом аммония:
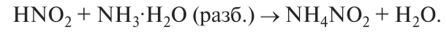
3. При взаимодействии с кислородом воздуха на свету азотистая кислота превращается в азотную:
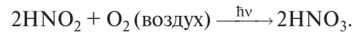
4. Окислительно-восстановительные свойства:
О HN02 — сильный окислитель:
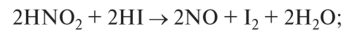
О восстановительные свойства — проявляет с сильными окислителями:
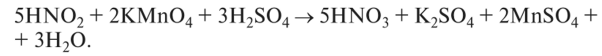
Соли азотистой кислоты — нитриты — ядовиты, устойчивее HN02. Обладают окислительной и восстановительной активностью. Нитриты щелочных металлов плавятся без разложения. Нитриты других металлов разлагаются при нагревании на оксид металла, N0 и N02.
Азотная кислота HN03 — бесцветная жидкость с резким удушливым запахом. Неограниченно смешивается с водой. Разбавленная азотная кислота — 40—60 масс. %, дымящаяся — 70—80 масс. %, концентрированная — 96—98 масс. %. Пары азотной кислоты сильно ядовиты, попадание на кожу HN03 (конц.) приводит к тяжелым ожогам.
Химические свойства
1. Разлагается при стоянии на свету (желтеет):
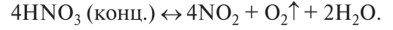
- 2. Сильная кислота, вступает в реакции, характерные для кислот:
- 0 нейтрализуется щелочами и гидроксидом аммония:
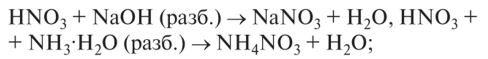
0 реагирует с основными и амфотерными оксидами и гидроксидами: 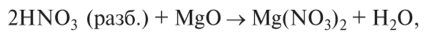
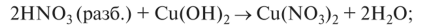
О вытесняет слабые кислоты из их солей:
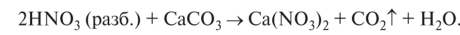
3. Азотная кислота — сильнейший окислитель. При ее взаимодействии с металлами никогда не выделяется водород. Концентрированная азотная кислота пассивирует (образует нереакционноспособную труднорастворимую пленку из оксида металла на его поверхности) Al, Сг, Fe, Ni, Pb; не реагирует с Au, Pt; с остальными металлами реагирует и получающиеся продукты зависят от степени разбавления азотной кислоты:
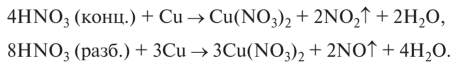
Взаимодействует с неметаллами:
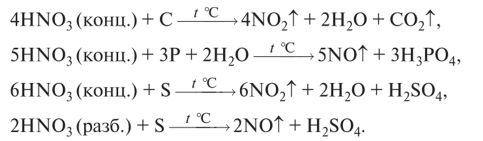
Смесь концентрированных азотной и соляной кислот — «царская водка» — обладает более выраженными окислительными свойствами, чем концентрированная азотная кислота, растворяет благородные металлы (золото, платину):
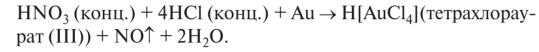
Соли азотной кислоты — нитраты — получают действием HN03 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде, не обладают окислительными свойствами в растворе, только в расплавах:
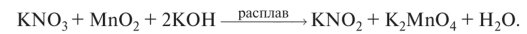
При нагревании все нитраты разлагаются с выделением кислорода и продуктов разложения в зависимости от активности металла, входящего в состав соли:
О нитраты щелочных металлов разлагаются на нитриты и кислород:
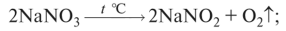
О нитраты от Mg до Си разлагаются до оксида металла, N02 и кислорода:
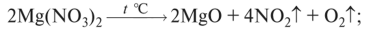
О нитраты после Си разлагаются до свободного металла, N02 и кислорода:
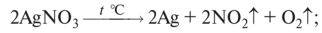
О нитрат аммония разлагается до N20 и воды:
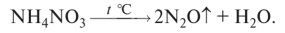
Получение. В лабораторных условиях осуществляется действием H2S04 на нитраты:
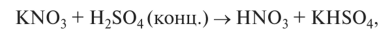
в промышленности — каталитическим окислением аммиака с последующим окислением получившегося монооксида азота до диоксида кислородом воздуха и растворением его в воде (реакции см. выше).
Применение. Азотная кислота используется для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей и лекарственных препаратов.








