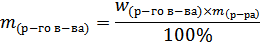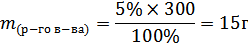Тема: Тема 4. Свойства растворов.
Урок № 4.7. Влияние различных факторов на растворимость газов, жидкостей и твердых веществ
Урок № 4.8. Использование факторов растворимости в технологии продукции питания
Цели урока:
Образовательная: изучить понятие массовая доля растворенного вещества; научить решать задачи по теме;
Развивающая: развивать умение применять полученные знания при решении задач; развивать у учащихся логическое мышление путем сравнения, обобщения, анализа.
Воспитательная: воспитывать культуру поведения во время урока, культуру взаимоотношений.
Задания для всесторонней проверки знаний
Что такое раствор?
Растворы делятся по агрегатному состоянию компонентов на ...?
А по количеству растворенного вещества?
Назовите типы дисперсных систем.
Коэффициент растворимости
Способность веществ растворяться в каком-либо растворителе называется растворимостью.
Из жизненного опыта вам известно, что растворимость веществ не безгранична.
По степени растворимости вещества можно разделить на:
· практически нерастворимые (хлорид серебра — 0,0015 г/л);
· малорастворимые (гипс — 2 г/л);
· хорошо растворимые (сахар — 2000 г/л).
Растворимость кислот, оснований и солей можно определить, пользуясь таблицей растворимости на форзаце учебника химии.
Растворимость большинства твёрдых веществ (за исключением немногих, например, гипса, извести) с повышением температуры возрастает.
Коэффициент растворимости — это отношение массы вещества, образующего насыщенный при данной температуре раствор, к объёму растворителя.
Зависимость растворимости от различных факторов
Растворимость зависит от природы растворителя и растворяемого вещества, их агрегатного состояния, температуры и давления (для газов).
Давление практически не оказывает влияния на растворимость твёрдых веществ и жидкостей.
Растворимость газов бывает различна. Некоторые газы (водород, инертные газы) малорастворимы в воде. Другие газы (аммиак, хлороводород) хорошо растворимы.
Растворимость газов возрастает при понижении температуры и повышении давления.
Основное влияние на растворение жидкостей оказывает природа растворённого вещества и растворителя.
Со времён алхимии известно «золотое правило» — подобное растворяется в подобном. Так, в полярных растворителях (вода и др.) хорошо растворяются вещества с ионной и ковалентной полярной связями (кислоты, соли, щёлочи). В неполярных растворителях, как правило, растворяются вещества с неполярной связью (водород, сера, углерод и др.).
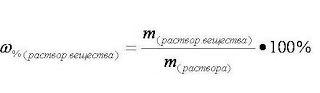
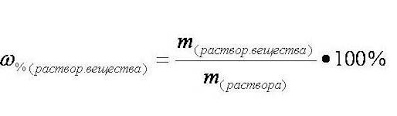
Массовая доля растворенного вещества
Существуют различные способы выражения концентрации растворённого вещества в растворе, мы познакомимся с массовой долей растворённого вещества (процентной концентрацией).
Массовая доля растворённого вещества w растворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества m(р-го в-ва) к общей массе раствора m(р-ра):
m(р-ра)=m(р-го в-ва)+m(р-ля)
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!
 Пример решения задачи:
1. Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
Пример решения задачи:
1. Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
«Вычисление массовой доли растворённого вещества» 2. Сахар массой 12,5г растворили в 112,5г воды. Определите массовую долю сахара в полученном растворе.
«Вычисление массовой доли растворённого вещества в растворе, полученном при смешивании двух растворов» 3. Смешали два раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. Вычислите массовую долю соли в образовавшемся растворе.
|
Задания для закрепления новых знаний
1. Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли.
2. Рассчитайте массы соли и воды, необходимые для приготовления 400г раствора с массовой долей соли 0,05.
3. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г воды.
4. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г соли.