Методы получения коллоидных растворов
Коллоидные растворы могут быть получены:
1. Дисперсионными методами, основанными на дроблении, или диспергировании крупных частиц вещества до коллоидных размеров. Диспергирование можно проводить механическим измельчением, электрическим распылением и так далее.
К дисперсным методам относятся – процесс образования золей из гелей или рыхлых осадков при действии на них пептизаторов (в большинстве случаев электролитов), адсорбирующихся на поверхности коллоидных ядер и способствующих их взаимодействию с дисперсионной средой.
2. Конденсационными методами, основанными на агрегации молекул или ионов более крупные частицы. Агрегацию частиц можно осуществлять различными способами.
При конденсационном методе рост частиц прекращается задолго до образования термординамически устойчивой поверхности раздела. Поэтому коллоидные системы, независимо от способа получения, являются термодинамически неустойчивыми. Со временем, в результате стремления к термодинамически более выгодному состоянию, коллоидные системы прекращают существование вследствие коагуляции – процесса укрупнения частиц.
К физико-химической конденсации относится метод замены растворителя, который сводится к тому, что вещество, из которого предполагается получить золь, растворяют в соответствующем растворителе в присутствии стабилизатора (или без него) и затем раствор смешивают с избытком другой жидкости, в которой вещество нерастворимо. В результате образуется золь. Так получают золи серы, канифоли. За счет чего в данном случае возникает пресыщение.
Химический метод конденсации основан на реакциях, приводящих к возникновению твердого продукта.
а) Реакции восстановления.
Например, получение золей золота и серебра при взаимодействии солей этих металлов с восстановителями:
2KAuO2 + 3HCHO + K2CO3 → 2Au + 3HCOOK + KHCO3 + H2O.
{[mAu]·nAuO2–·(n–x)К+}x–·xК+ – мицелла золя золота.
б) Реакции окисления.
Например, получение золя серы:
2Н2S + O2 → 2S + 2H2O.
Строение мицеллы полученного золя можно представить следующей формулой:
{[mS]·nS5O62–·2(n–x)H+}·2xH+.
в) Реакции обмена. Например, получение золя сульфата бария.
При использовании реакций обмена состав мицелл зависит от того, в каком порядке сливают растворы реагентов!
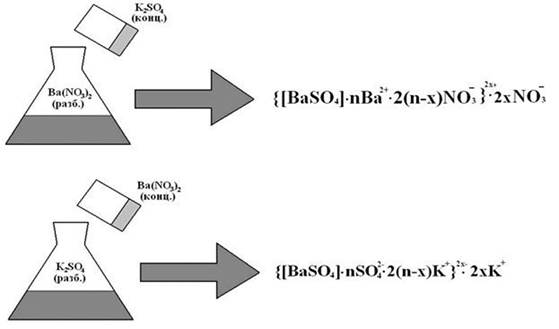
г) Реакции гидролиза.
Например, красно-бурый золь гидроксида железа (III) получается, если в кипящую воду добавить небольшое количество хлорида железа (III): FeCl3 + H2O → Fe(OH)3 + 3HCl.
Строение мицеллы золя Fe(OH)3 в зависимости от того, какой ион является стабилизатором, может быть выражено формулами:
{[mFe(OH)3]·nFeO+·(n–x)Cl–}x+·xCl–
или {[mFe(OH)3]·nFe3+·3(n–x)Cl–}3x+·3xCl–
или {[mFe(OH)3]·nH+·(n–x)Cl–}x+·xCl–.
Примером получения коллоидных систем кристаллизацией является кристаллизация из пересыщенного раствора сахарозы в производстве сахара. Процесс десублимации имеет место при образовании облаков, когда в условиях переохлажденного состояния из водяных паров образуются сразу кристаллики, а не капли воды.
Свойства коллоидных систем:
· рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
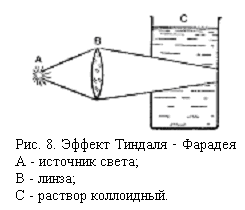 Опалесценция становится особенно заметной, если, как это делал Тиндаль (через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу. При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
Опалесценция становится особенно заметной, если, как это делал Тиндаль (через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу. При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).

· медленная диффузия
· малое осмотическое давление
· коллоидные растворы способны к диализу, т.е. с помощью мембраны могут быть отделены от примесей
· способны к коагуляции (разрушению) системы при: добавлении примесей, изменении Т, перемешивании и т.д.
· иногда обнаруживают явление электрофореза, т.е. частицы в системе могут обладать зарядом.








