Тема 6. Коллоидная химия
Урок № 6.5. Коллоидные растворы (золи): понятие, виды, общая характеристика.
Урок № 6.6. Свойства коллоидных растворов.
1.Мотивация темы
Коллоидные системы широко распространены в природе. Белки, кровь, лимфа, углеводы, пектины находятся в коллоидном состоянии. Многие отрасли производства (пищевая, текстильная, резиновая, кожевенная, лакокрасочная, керамическая промышленности, технология искусственного волокна, пластмасс, смазочных материалов) связаны с коллоидными системами. Производство строительных материалов (цемент, бетон, вяжущие растворы) основано на знании свойств коллоидов. Угольная, торфяная, горнорудная и нефтяная промышленность имеют дело с дисперсными материалами (пылью, суспензиями, пенами). Особое значение коллоидная химия приобретает в процессах обогащения полезных ископаемых, дробления, флотации и мокрого обогащения руд. Фото- и кинематографические процессы также связаны с применением коллоидно-дисперсных систем.
К объектам коллоидной химии следует отнести все многообразие форм растительного и животного мира, в частности, типичными коллоидными образованиями являются мышечные и нервные клетки, клеточные мембраны, волокна, гены, вирусы, протоплазма, кровь. Поэтому ученый-коллоидник И.И.Жуков констатировал, что «человек по существу – ходячий коллоид». В свете этого, технологию лекарственных средств (мазей, эмульсий, суспензий, аэрозолей, порошков), действие различных лекарств на организм невозможно представить без знаний коллоидной химии.
2.Цели и задачи.
Цель: приобретение системных знаний о коллоидно-дисперсных системах в зависимости от признаков классификации, о методах получения, очистки и об устойчивости дисперсных систем и умение применять эти знания к конкретным системам, встречающиеся в биологических объектах.
Задачи:
образовательная:
ознакомить студентов с понятием дисперсные системы, коллоидные растворы.
ознакомить студентов с методами получения коллоидных растворов.
разъяснить студентам способы очистки коллоидных растворов, строение мицеллы.
ознакомить студентов со свойствами коллоидных растворов.
развивающая:
продолжить и расширить познавательную деятельность студентов, а также их представления о способах получения коллоидных растворов.
продолжить развивать и расширить представления студентов о диализе, электродиализе, ультрафильтрации, о составных частях коллоидной частицы, и их практическом значении в повседневной жизни.
воспитывающая:
продолжить воспитывать внимательность, наблюдательность, эстетические чувства, навыки работы с техникой.
3. Информационный блок.
Дисперсные системы – гетерогенные системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом (дисперсионная среда). Свойства вещества в раздробленном (дисперсном) состоянии значительно отличаются от свойств того же вещества, находящегося в виде твердого тела или некоторого объема жидкости.
Существует несколько различных классификаций дисперсных частиц: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды, по характеру взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды, по термодинамической и кинетической устойчивости.
В зависимости от размеров частиц дисперсной фазы а выделяют следующие дисперсные системы
Дисперсные системы
| Размер частицы | Название |
| а ≤ 10-9 м | Истинные растворы |
| а = 10-9–10-7 м | Коллоидные системы |
| а ≥ 10-7–10-5 м | Грубодисперсные системы |
Классификация дисперсных систем по агрегатным состояниям дисперсной фазы и дисперсионной среды приведена в таблице
Классификация дисперсных систем
| Дисперсная фаза | Дисперсионная среда | ||
| Газ | Жидкость | Твердое тело | |
| Газ | Не образуется | Пена | Твердая пена |
| Жидкость | Аэрозоль | Эмульсия | Твердая эмульсия |
| Твердое тело | Аэрозоль, порошок | Суспензия и золь | Твердый золь |
Коллоидные растворы
Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 10ˉ7 до 10ˉ5 см. Суммарная их поверхность огромна, и она обладает поверхностной энергией, за счет которой может адсорбировать частицы из раствора. Образующаяся коллоидная частица называется мицеллой. Она имеет сложное строение и состоит из ядра, адсорбированных ионов, противоионов.
Если растворитель взаимодействует с ядром частицы, то образуются лиофильные коллоиды, если не взаимодействует – то лиофобные коллоиды.

Историческая справка
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм(1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия. Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус, итальянский химик Франческо Сельми. В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.). Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком. Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Английский ученый Майкл Фарадей(*) в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид». Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами (NaCl, сахароза). В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки. Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей). Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Мицелла и её строение
Коллоидная частица представляет собой ядро из малорастворимого вещества коллоидной дисперсности, на поверхности которого адсорбируются ионы электролита раствора. Ионы электролита обеспечивают устойчивость золя, поэтому данный электролит называют ионным стабилизатором. Значит, коллоидная частица представляет собой комплекс, состоящий из ядра, вместе с адсорбционным слоем противоионов. Агрегат частицы или ядро представляет собой вещество кристаллического строения, состоящий из сотен или тысячи атомов, ионов или молекул, окружённый ионами. Ядро вместе с адсорбированными ионами называется гранулой. Так гранула имеет определённый заряд. Вокруг неё собираются противоположно заряженные ионы, придающие ей в целом электронейтральность. Вся система, состоящая из гранулы и окружающих её ионов называется мицеллой и является электронейтральной. Жидкая фаза, окружающая мицеллу, называется интермицелярной жидкостью. Это можно представить в виде следующей краткой схемы:
гранула, т.е. коллоидная частица = ядро + адсорбционный слой + противоионный слой + диффузный слой
мицелла = гранула + противоионы
золь = мицеллы + интермицеллярная жидкость.
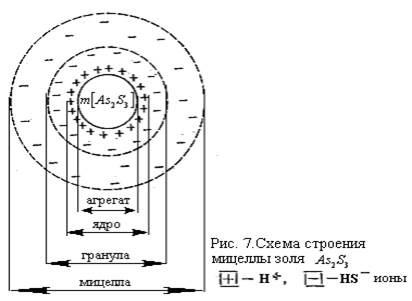
Рассмотрим в качестве примера золь As2S3 (рис 7). Для получения данного золя на мышьяковую кислоту нужно подействовать сероводородом. Протекающую реакцию можно написать следующим образом:
2H3AsО3+ 3H2S= As2S3+ 6 H2О
Избыток H2S в данной системе играет роль ионного стабилизатора. H2S частично диссоциирует на ионы:
H2S↔ HS-+ H+
Из этих ионов HS- ионы адсорбируются на поверхности ядра мицеллы As2S3, поэтому в этой системе:
[ As2S3 ]n- агрегат
[ As2S3 ]n, m HS- -ядро
{[ As2S3 ]n, m HS -,(m-x) Н+}-x -гранула
{[ As2S3 ]n, m HS -,(m-x) Н+}-x Н+- мицелла
Ядра мицелл имеют кристаллическое строение. Процесс образования коллоидных частиц был подробно исследован В.А. Каргиным и З.Я. Берестневой в 1953 году при помощи электронного микроскопа и создана новая теория. Согласно этой теории механизм образования коллоидной частицы происходит в два этапа: сначала образуются шарообразные частицы, находящиеся в аморфном состоянии, в дальнейшем же внутри аморфных частиц возникают мелкие кристаллы. Благодаря возникновению кристаллических структур внутри аморфных частиц создаётся напряжение и согласно минимуму внутренней энергии системы при соблюдении условий (∆Н<0, ∆S<0), |∆Н| >|Т∆S|, ∆G<0) происходит самопроизвольный процесс распада на множество мелких кристаллических частиц и эти кристаллы становятся центром мицеллы. Скорость кристаллизации для различных золей различна.