Ерітіндідегі заттың массалық үлесін есептеуге арналған формулалар.



Ерітіндіге байланысты есептеулер
Ерітінділер кемінде екі компонеттен тұрады. Олардың біреуі – еріген зат, екіншісі – еріткіш деп аталады. Олардың арасындағы айырмашылық кейде шартты түрде ғана болады. Егер ерітіндіде химиялық реакция жүретін болса, реакцияға қатынаспайтын компонент еріткіш деп есептеледі. Сулы ерітінділерде су еріткіш болып табылады.
Ерітіндінің маңызды сипаттамасы – оның сандық құрамы. Ерітіндідегі еріген заттың мөлшерін концентрация деп атайды. Ерітіндіде еріген заттың мөлшері көп болса, ерітінді – концентрациялы, ал аз болса – сұйытылған деп аталады.
Концентрацияны белгілеудің бірнеше әдісі бар. Солардың ең жиі қолданылатыны – ерітіндідегі заттың массалық үлесі немесе проценттік концентрация. Молярлық концентрацияны белгілеудің басқа тәсілдері сиректеу қолданылады.
Ерітіндідегі заттың массалық үлесін есептеуге арналған формулалар.
1. Еріген заттың массалық үлесін есептеу:
m (ер.зат)
ω (ер.зат) = ––––––––––––– •100%
m (ерітінді)
2. Берілген массалық үлесі бойынша еріген заттың массасын табу:
m (ер.зат) = ω (ер.зат) •m (ерітінді)
3. Ерітіндінің массасын табу:
m (ерітінді)= m (ер.зат)
––––––––––––– немесе m (ерітінді)= m (ер.зат) + m (еріткіш)
ω (ер.зат)
4. Еріткіштің массасын табу:
m (еріткіш)= m (ер.зат) - m (ерітінді)
5. Еріткіштің массалық үлесін табу:
ω (еріткіш)=1- ω (ер.зат) немесе ω %(еріткіш)=100%- ω %(ер.зат)
ЕРІТІНДІГЕ БАЙЛАНЫСТЫ ЕСЕПТЕР
8 - 9 сынып
Ерітінді дайындауға арналған есептер:
Массалық үлесі 0,06 немесе 6 % массасы 230 г калий нитратының ерітіндісін дайындауға қажетті су мен калий нитратының массаларын есептеңіздер.
Берілгені:
ω1 (КNО3) =0,06%
m (КNО3) = 230 г
Т/к: m (КNО3) , m (Н2О)-?
Шешуі:
1) Массалық үлестері бойынша ерітіндідегі таза заттардың массаларын есептейміз:
m (ер.зат)
ω (ер.зат) = ––––––––––––– •100%
m (ерітінді)
m (ер.зат) = ω (ер.зат) •m (ерітінді)
m (КNО3) = 0,06•230 = 13,8 г
2) Ерітінді дайындау үшін қажетті судың массасы:
M (Н2О) = m (ер-ді) – m (КNО3) = 230 -13,8 = 216,2 г
Жауабы: КNО3 - 13,8 г; Н2О - 216,2 г.
Массасы 25 г мыс купоросын (СuSO 4 •5Н 2 О) көлемі 200 мл ( р = 1 г/см³) суда ерітті. Алынған ерітіндідегі сусыз мыс сульфатының массалық үлесін (%) есептеңіздер.
Берілгені:
m (СuSO4•5Н2О ) = 25 г
V(H2О) = 200 мл
р (H2О ) = 1 г/см³
Т/к: ω (СuSO4)-?
Шешуі:
1) Мыс купоросы мен мыс сульфатының молярлық массаларын есептейміз:
М (СuSO4•5Н2О) = 63,5 +32+16•4 +18•5= 249,5 г/моль
М (СuSO4) = 63,5 + 32 + 16•4 = 159,5 г/моль
2) Кристаллогидрат құрамындағы сусыз мыс сульфатының массасы:
249,5 г СuSO4•5Н2О ––––––––––– 159,5 г СuSO4
25 г СuSO4•5Н2О ––––––––––– х г СuSO4
159,5•25
х = –––––––––– = 15,98 г
249,5
3) Еріткіштің массасын анықтаймыз:
M (Н2О) = V(Н2О) •p (Н2О) =200 •1 = 200 г
4)Түзілген ерітіндінің массасы:
m (ерітінді) = m (еріткіш) + m(тұз)
m (ерітінді) = 200 +25 = 225 г
5) Мыс сульфатының массалық үлесі:
m (ер.зат)
ω (ер.зат) = ––––––––––––– • 100 %
m (ерітінді)
15,98 г •100 %
ω (СuSO4) = ––––––––––––– = 7,1 %
225
Жауабы: 7,1 %.
Еріген заттың массалық үлесі 50 % , р = 1,3 г/см³, көлемі 250 см³ азот қышқылының ерітіндісіне көлемі 1 л су қосылғанда түзілген ерітіндідегі азот қышқылының массалық үлесін (%) есептеңіздер.
Берілгені:
ω1 (НNО3) = 50 %
V(ер-ді) = 250 см³
р (ер-ді) = 1,3 г/см³
V(H2О) =1 л
Т/к : ω2 (НNО3)-?
Шешуі:
1) Массалық үлесі 50 %-қ ерітіндідегі азот қышқылының массасын есептейміз:
100 г ерітіндіде ––––––––––– 50 г НNО3 болса,
250 – 1,3 г ерітіндіде ––––––––––– х г НNО3 бар.
250 - 1,3 • 50
х = –––––––––––– = 162,5 г
100
2) Массалық үлесі 50 %-қ ерітіндінің массасы:
m (ер-ді) = V(ер-ді) • р (ер-ді) = 250 см³•1,3 г/см³ = 325 г
3) Қышқыл мен судан тұратын ерітіндінің массасы:
m (ер-ді) = 1000 +325 = 1325 г
4) Су қосылған ерітіндідегі азот қышқылының массалық үлесі:
m (ер.зат)
ω (ер.зат) = ––––––––––––– • 100 %
m (ерітінді)
162,5г •100 %
ω2 (НNО3) = –––––––––––––– = 12,26 %
1325 г
Жауабы: 12,26 %
Массалық үлесі 20 %-қ массасы 500 г ерітінді дайындау үшін массалық үлестері 10 % және 30 % болатын бірдей тұз ерітінділерінің қандай массасы қажет?
Берілгені:
ω1 = 10 %
ω2 = 30 %
ω3 = 20 %
m3 = 500 г
Т/к: m1 , m2-?
Шешуі:
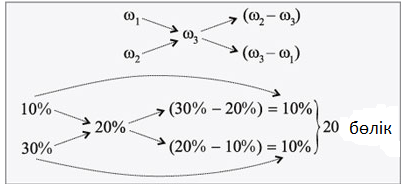
20 %- қ 500 г тұз ерітіндісін дайындау үшін бастапқыда алынған ерітінділердің концентрациясынан 10 бөліктен алу керек. 1 бөлік 500 :(10 + 10) = 25 грамға тең, ал 10 бөлік 25 •10 = 250 г бұдан, m1 = 250 г; m2 = 250 г
Есепті тексеру
10 %-қ 100 г ерітіндіде ––––––––––– 10 г тұз болса,
10 %-қ 250 г ерітіндіде ––––––––––– х г тұз болады.
250 •10
z = –––––––––– = 25 г
100
30 %-қ 100 г ерітіндіде ––––––––––– 30 г тұз болса,
30 %-қ 250 г ерітіндіде ––––––––––– у г тұз болады.
250 •30
у = –––––––––– = 75 г
100
m ( ерітінді) = 250+250 = 500 г
m(тұз) = 25 + 75 = 100 г.
Бұдан  3 табамыз :
3 табамыз :
500 г ерітіндіде ––––––––––– 100 г тұз болса,
100 г ерітіндіде –––––––––––  3 г тұз болады.
3 г тұз болады.
100 •100
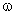 3 = –––––––––– = 20 г немесе 20 %
3 = –––––––––– = 20 г немесе 20 %
500
Жауабы: m1 = 250 г, m2 = 250 г.
Массалық үлесі 0,3 немесе 30 % -қ 150 г натрий хлоридінің ерітіндісі мен массалық үлесі 0,1 немесе 10 % -қ 250 г натрий хлоридінің ерітіндісін араластырған. Алынған ерітіндідегі натрий хлоридінің массалық үлесі (%) қандай? Берілгені:
m1(NaCІ ) = 150 г
m2(NaCІ ) = 250 г
ω1(NaCІ ) = 30 %
ω2(NaCІ ) = 10 %
Т/к ω3(NaCІ )
Шешуі: 1- әдіс ( пропорция әдісі)
1) Ерітіндінің жалпы массасы:
m3 = m1 + m2 = 150 + 250 = 400 г
2) Бірінші және екінші ерітіндідегі натрий хлоридінің масссасын анықтаймыз:
100 г ерітіндіде ––––––––––– 30 г NaCІ болса,
150 г ерітіндіде ––––––––––– х г NaCІ бар.
30 •150
х = –––––––––– = 45 г
100
100 г ерітіндіде ––––––––––– 10 г NaCІ болса,
250 г ерітіндіде ––––––––––– у г NaCІ бар.
10 •250
у = –––––––––– = 25 г
100
3) Түзілген ерітіндінің құрамындағы натрий хлоридінің массасы:
45 +25 =70 г
4) Түзілген ерітіндінің концентрациясы:
400 г ерітіндіде ––––––––––– 70 г NaCІ болса,
100 г ерітіндіде ––––––––––– z г NaCІ бар.
70 •100
z = –––––––––– = 17,5 г немесе 17,5 %
400
Жауабы: 17,5 %.
Ерігіштік
Ерігіштік — заттың белгілі бір еріткіште еру қабілеті. Белгілі бір жағдайдағы заттың ерігіштігінің сипаттамасы ретінде оның қаныққан ерітіндідегіконцентрациясы алынады. Сондықтан ерітіндінің құрамын қалай сипаттаса, Ерігіштікті де сан жағынан солай сипаттайды. Мысалы, заттың белгілі бір температурада белгілі бір еріткіштегі Ерігіштігін оның қаныққан ерітіндісіндегі еріген заттың массалық үлесімен не оның молярлық концентрациясымен (моль/л) сипаттауға болады. Ерігішті, көбінесе, еріткіштің 100 массалық бірлігінде қаныққан ерітінді түзілгенше еритін еріген заттың масса бірлігімен көрсетеді. Оны кейде Е. коэффициенті деп те атайды. Заттардың судағы Ерігіштегі әр түрлі. Егер 100 г суда еритін заттың массасы 10 г-нан асса — жақсы еритін, 1 г-нан кем болса — нашар еритін, 0,01 г-нан аз болса — іс жүзінде ерімейтін зат деп есептеледі. Заттардың Ерігіштігін алдын ала болжауға мүмкіндік беретін теориялар әзірге жасалған жоқ. Дегенмен химиктер кейбір заңдылықтарды байқады. Мысалы, молекулалары полюсті немесе иондық байланыспен байланысқан заттар (су, спирт, сұйық аммиак) полюсті еріткіштерде жақсы еритіндігі, ал молекулалары полюссіз заттар (бензол, күкіртті көміртек) полюссіз еріткіштерде еритіндігі анықталды. “Ұқсас заттар бір-бірінде жақсы ериді” деген ескі қағида осы заңдылықты тұжырымдайды. Сонымен қатар заттар ерігенде мынадай құбылыстар байқалады: жылу бөлінеді не сіңіріледі, ерітіндінің көлемі азаяды (көлемнің контракциясы) және түсі өзгереді. Осы құбылыстардың барлығы еріген зат пен еріткіш молекулалары арасында химиялық әрекеттесулер бар екендігіне дәлел.[1]
· Мұнайдың суда ерігіштігі. Судың мұнаймен
жапсарласуы барысында оның сол суда азды-көпті еру процесі. Бұл процестің қарқындылығы мұнайдың химиялық құрамына , температураға және судың минералдану дәрежесіне тәуелді.· Газдың суда ерігіштігі. Газдың сумен жапсарласуы барысында оның сол суда еру қабілеті. Мұның нәтижесінде су мен газ тепе-тең жағдайға шейін жетуі мүмкін. Газдың суда ерігіштігі қысым өскен сайын, ал судың минералдану дәрежесі азайған сайын арта түседі.
· Газдың (табиғи көмірсутектік) мұнайда ерігіштігі. Табиғи көмірсутектік газдың нақтылы термобаралық жағдайларда мұнайлы қойнауқатта біртекті сұйық жүйе қалыптастыру қабілеті. Кәсіптік геологияны көбінесе кенорынды игеру барысындағы мұнайдың газдан арылу процестері қызықтырады. Алайда Газдың (табиғи көмірсутектік) мұнайда ерігіштігі мөлшерін білу де қажет-ақ, себебі ол қойнауқаттық мұнайдың көлемдік коэффициентін анықтау, қойнауқатты газбен тоғыту мәселелерін шешу, қойнауқатқа әсер ету процесін игерудің кешеуілдеуі салдарынан бөлініп шығатын газды еріту шараларын күн тәртібіне қою барысында керек болады.
·
- Ерігіштікке байланысты есептерді шығаруға қажетті берілген заттардың әртүрлі температурадағы ерігіштіктерді есептің шартында беріледі. Қажетті ерігіштіктер есепте келтірілмеген жағдайда, оны мына кестеден білуге болады .
- Кейбір заттардың судағы ерігіштігі
| Заттар | 10 °C | 20 °C | 30 °C | 40 °C | 60 °C | 80 °C |
| AgNO3 | 0,634 | 0,690 | 0,733 | 0,763 | 0,818 | 0,858 |
| Al(NO3)3 | 0,360 | 0,385 | 0,405 | 0,430 | 0,485 | 0,550 |
| B(OH)3 | 0,035 | 0,046 | 0,063 | 0,082 | 0,130 | 0,191 |
| BaCl2 | 0,252 | 0,266 | 0,279 | 0,292 | 0,317 | 0,343 |
| Ba(NO3)2 | 0,063 | 0,083 | 0,104 | 0,125 | 0,169 | 0,210 |
| CaCl2 | 0,394 | 0,427 | 0,500 | 0,536 | 0,578 | 0,595 |
| CoCl2 | 0,323 | 0,346 | 0,374 | 0,410 | 0,484 | 0,494 |
| CuCl2 | 0,417 | 0,427 | 0,439 | 0,450 | 0,472 | 0,495 |
| CuSO4 | 0,147 | 0,170 | 0,196 | 0,223 | 0,283 | 0,357 |
| KAl(SO4)2 | 0,038 | 0,056 | 0,077 | 0,105 | 0,198 | 0,415 |
| KBr | 0,373 | 0,395 | 0,415 | 0,431 | 0,461 | 0,486 |
| KCl | 0,238 | 0,256 | 0,277 | 0,287 | 0,314 | 0,338 |
| K2Cr2O7 | 0,072 | 0,111 | 0,154 | 0,206 | 0,313 | 0,422 |
| KNO3 | 0,175 | 0,240 | 0,315 | 0,390 | 0,524 | 0,628 |
| K2SO4 | 0,085 | 0,100 | 0,115 | 0,129 | 0,254 | 0,276 |
| NH4Cl | 0,249 | 0,271 | 0,293 | 0,314 | 0,356 | 0,396 |
| Na2B4O7 | 0,016 | 0,024 | 0,038 | 0,060 | 0,148 | 0,195 |
| NaNO3 | 0,444 | 0,467 | 0,490 | 0,512 | 0,555 | 0,598 |
| NiSO4 | 0,248 | 0,277 | 0,306 | 0,325 | 0,363 | 0,400 |

1-мысал: 200 г суды 80°С-қа дейін қыздырғанда калий хлоридінің қандай массасын ерітуге болатынын анықтаңдар.
Берілгені: Шешуі:
m(H2O)- 200 1) 100г суда 80°C-та қанша грамм тұз еритінін табайық. Тұздардың ерігіштік
t°-80°C графиктерінен калий хлоридінің 80°C-та ерігіштігі 50 грамға тең екенін
Табу керек: табамыз. Бұл осы температурада судың 100 грамында калий хлоридінің
m(KCl) 50 грамы еритінін көрсетеді. 80°С-та 200г суда еритін тұздың массасын есептейміз:
100г суда_____ 50г тұз ерісе,
200г ____х1 г тұз ериді.
100/200=50/x1, х1=100г, m(KCl)=100г
Жауабы: m(KCl)=100г
2-мысал: 100г суды 80°C-қа дейін қыздырғанда түзілген калий хлоридінің қаныққан ерітіндісін 20°С-қа дейін суытқанда қанша грамм тұздың қайта кристалданатынын (тұнбаға түсетін) табыңдар.
Берілгені: Шешуі:
m (H2O) -100г Қосымшадағы 2-кестені пайдаланып 80°С –та 100г суда калий хлоридіні 50
t°₁ - 80°C грамы ерісе, 20°С-та оның 35 грамы еритіндігін табамыз.
t°₂-20°C Ерітіндіні 80°С-тан 20°С-қа дейін суытқанда кристалданатын тұздың массасы:
Табу керек: ∆m (KCl)=m₁(KCl)-m₂(KCl)= 50-35=15г
∆m (KCl)-?
Жауабы: 80°С-та 100г суда калий хлоридін ерітіп алған ерітіндіні 20°С-қа дейін суытқанда 15г KCl тұнбаға түседі.
3-мысал: 20°С-та калий хлоридінің қаныққан ерітіндісіндегі тұздың массалық үлесін есептендер.
Берілгені: Шешуі:
Қаныққан ерітінді KCL 2-кестеге қарап 20°та «ққг калий хлоридінің ерігіштігі 35-ке тең екенін
t°-20C табамыз. Яғни, 100г суда 35г KCl ериді. Олай болса ерітіндінің массасы:
Табу керек: m(ерітінді)=100г + 35г = 135
ω(KCl)-? Еріген тұздың массалық улесі:
ω(KCl)=m( KCl)/m(ерітінді)=35/135=0,25 немесе 25%
Жауабы: ω(KCl)=25%
4-мысал: Калий бихроматының 60°С кезіндегі ерігіштігі 32,8% ал 10°С кезіндегі ерігіштігі 7,8 %. Калий бихроматының 60°С температурада қаныққан ерітіндісінің 200 грамын 10°С температураға дейін суытқанда калий бихроматының қандай массасы тұнбаға түседі?
Шешуі:
Алдымен калий бихроматының 60°С кезінде қаныққан ерітіндісінің 200 грамында еріген тұздың массасын табамыз:
Егер 100г қаныққан ерітіндіде 32,8г еріген зат болса, онда 200г қаныққан ерітіндіде хг калий бихроматы еріген.
(200*32.8)
Х=__________=65,6
100
Демек, судың массасы: 200-65,5=134,4г H₂O
Енді 60°С кезінде қаныққан ерітіндіні 10°С температураға дейін суытқанда тұнбаға түсетін калий бихроматының массасын есептейік.Егер калий бихроматының ерігіштігі 7,8% болса, онда демек 92,2г суда 7,8 г калий бихроматы еріген.
Осыны пайдаланып, пропорция құрамыз,
Егер 92,2г суда 7,8 K₂Cr₂O₇ еріген болса, онда 134,4г суда Хг K₂Cr₂O₇ еріген.
(134.4*7.8)
Бұдан: х=______________= 11.37 K₂Cr₂O₇
92.2
Демек, 60°С кезіндегі қаныққан ерітіндіні 10°С-қа дейін суытқанда 11,37г K₂Cr₂O₇ ерітіндіде қалады. Яғни, 65,5-11,37=54,23г калий бихроматы кристалданып, тұнбаға түседі.
ЕСЕПТЕР
А- деңгейі:
1) 25 %-қ 300 г ерітінді дайындау үшін тұздың массалық үлестері 60 % -қ және 10 %-қ екі ерітіндінің қандай массаларын араластыру қажет? Жауабы: m 1 - 90 г, m 2 - 210 г.
2) 45 %-қ 250 г ерітіндіні су қосып сұйылтқанда массалық үлесі 10 % -қ ерітінді алынды. Судың массасын есептеңіздер.








