Тема 6.Коллоидная химия
Урок № 6.1. Определение коллоидной химии
Урок № 6.2. Объекты и цели её изучения, связь с другими дисциплинами.
Урок № 6.3. Дисперсные системы, характеристика, классификация
Урок № 6.4. Использование и роль коллоидно-химических процессов в технологии продукции общественного питания.
Название коллоидной химии произошло от греческого – клей.
Первыми объектами изучения коллоидной химии являлись клееподобные вещества – желатин, пектин, казеин и другие высокомолекулярные соединения.
Коллоидная химия — один из разделов физической химии, изучающий физико-химические свойства систем, в которых одно вещество в виде отдельных частиц с размерами от 10-7 до 10-3 см распределено в другом веществе. Такие системы характеризуются большой суммарной поверхностью, что определяет особые свойства коллоидных растворов. Природные полимеры — белки, целлюлоза, крахмал, а также синтетические — полиэтилен, поливинилхлорид и др. имеют молекулы, которые по размерам соизмеримы с коллоидными частицами.
Коллоидная химия изучает такие хорошо знакомые из повседневной жизни объекты, как почва, торф, глина, бактерии, споры, активированный уголь, волокна, порошки, пыли, туманы. Для производства многих пищевых продуктов применяют методы дробления, фильтрации и адсорбции. А большинство используемого в пищевой промышленности сырья, полученных продуктов питания представляет собой или коллоидные системы, или высокомолекулярные вещества.
Современная коллоидная химия существенно расширила свои границы и из раздела физической химии выделилась в самостоятельную науку. И надо сказать, современная коллоидная химия – одна из немногих наук, название которой не соответствует содержанию. Она получила это название раньше, чем сформировалась в самостоятельную науку. В некоторых странах она переименована в "Поверхностные явления", "Поверхностные явления и дисперсные системы".
Объектами изучения современной коллоидной химии являются дисперсные системы и высокомолекулярные соединения. Особое внимание в коллоидной химии уделяется поверхностным явлениям – процессам, протекающим на границе раздела фаз.
В курсе физической химии мы рассматривали системы, в которых поверхность раздела не играла существенной роли. Чтобы поверхностные явления были ощутимы, поверхность раздела должна быть развитой, что достигается дроблением одной из фаз.
Основоположником коллоидной химии принято считать английского химика Т. Грэма, который разработал методы получения и очистки коллоидных растворов. Коллоиды, по Грэму, — это вещества, которые почти лишены способности к диффузии и проникновению через полупроницаемые перепонки, а также к кристаллизации. При осторожном упаривании коллоидных растворов остается клееподобная масса. Поэтому Грэм назвал класс таких веществ, как клей, желатин, гидроксид алюминия, кремниевая кислота и им подобные, коллоидами (от греч. colla — клей, eidos — подобный). Отсюда и получила свое название коллоидная химия. Грэм предложил коллоидно-химическую терминологию, которая используется и в настоящее время. Так, коллоидный раствор он назвал золем, а коллоидное вещество, выделенное из раствора в виде аморфного осадка, — гелем. Учение о коллоидах ранее являлось лишь главой физической химии. Со временем коллоидная химия выделилась в самостоятельную науку.
П 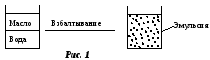 ример:
ример:
Чрезвычайно развитую поверхность раздела фаз имеют дисперсные системы.
ОСНОВНЫЕ СВОЙСТВА И КЛАССИФИКАЦИЯ
1.1 Основные свойства дисперсных систем
Гетерогенность. Любая дисперсная система состоит из двух и более фаз, т.е. гетерогенна (рис. 2).
Раздробленную (прерывную) часть дисперсной системы называютдисперсной фазой 1, а нераздробленную (непрерывную) – дисперсионной (сплошной) средой 2.
Между дисперсной фазой и дисперсионной средой образуется граница раздела. Необходимым условием образования дисперсной системы является нерастворимость или ограниченная растворимость дисперсной фазы и дисперсионной среды.
Дисперсные системы широко распространены в природе и технике: нефть, лаки, краски, дым, природные водоемы. Дисперсными системами являются большинство продуктов и полупродуктов пищевой промышленности: молоко, масло, пиво, крупы, майонез, хлеб и др.
В коллоидной химии изучаются дисперсные системы, в которых частиц дисперсной фазы имеют размер 10-9 - 10-7 м (1-100 нм). Это коллоидные системы.
Дисперсные системы с одинаковыми по размеру частицами называются монодисперсными, с различными по размеру частицами – полидисперсными. Реальные системы, как правило, полидисперсны.
Большая удельная поверхность. Количественной характеристикой межфазной поверхности дисперсных систем является удельная поверхность Sуд – площадь раздела фаз S, приходящаяся на единицу массы m или объема V дисперсной фазы:
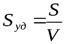 , м-1 или
, м-1 или 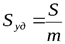 , м2/г.
, м2/г.
Если частицы дисперсной фазы имеют форму куба с длиной ребра а и одинаковы по размерам, то
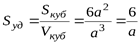 .
.
Для частиц сферической формы радиуса r
Sсф = 4pr2, Vсф = 4/3pr3, 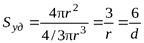 .
.
В общем случае для систем, содержащих частицы произвольной формы
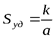 ,
,
где k – коэффициент, зависящий от формы частиц; а – выбранный линейный размер частиц (характерный размер).
Величина, обратная характерному размеру, называется дисперсностью D:
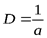 .
.
Из полученных соотношений видно, что, чем меньше характерный размер частиц дисперсной фазы, тем больше удельная поверхность и дисперсность. Покажем это на примере.
Рассмотрим частицу кубической формы.
| а, м | 1 | 10-1 | 10-3 | 10-5 | 10-7 | 10-9 |
| Sуд, м-1 | 6 | 60 | 6×103 | 6×105 | 6×107 | 6×109 |
Таким образом, при дроблении частиц резко возрастает удельная поверхность дисперсной фазы.
Большая нескомпенсированная поверхностная энергия. Различие состава соприкасающихся фаз и характера межмолекулярных взаимодействий в этих фазах обуславливает возникновение нескомпенсированной поверхностной энергии. Вследствие раздробленности и большой удельной поверхности раздела фаз дисперсные системы характеризуются значительным избытком поверхностной энергии.
Рассмотрим систему жидкость-газ.
Д  ля частиц, находящихся в объеме жидкой фазы, равнодействующая сил межмолекулярного взаимодействия равна 0, поскольку окружение со всех сторон одинаково. Векторы сил направлены в разные стороны, но равны по модулю. Получается симметричное силовое поле.
ля частиц, находящихся в объеме жидкой фазы, равнодействующая сил межмолекулярного взаимодействия равна 0, поскольку окружение со всех сторон одинаково. Векторы сил направлены в разные стороны, но равны по модулю. Получается симметричное силовое поле.
Частицы, расположенные на поверхности, взаимодействуют как с однородными частицами, так и с части-
цами другого рода. Естественно, что притяжение со стороны молекул газа слабее притяжения со стороны молекул жидкости. В результате несимметричности силового поля возникает результирующая сила, направленная внутрь более плотной фазы (жидкой). Эту силу часто называют внутренним давлением. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды оно составляет 14800 атм. Поэтому капельные жидкости при увеличении внешнего давления не изменяют свой удельный вес, т.е. они несжимаемы.
Для всех частиц поверхностного слоя нереализованная способность к взаимодействию со стороны одной из фаз (в данном случае газовой) характеризует свободную поверхностную энергию Gпов, которая и обусловливает протекание различных поверхностных процессов.
Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной ее поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение.
Поверхностное натяжение s – это физико-химическая величина, характеризующая работу термодинамически обратимого процесса образования единицы площади новой поверхности при постоянных температуре, давлении и составе жидкости.
Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого необходимо совершить работу против внутреннего давления, стремящегося втянуть молекулы поверхностного слоя внутрь фазы.
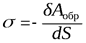 ,
,
где dАобр – термодинамически обратимая работа; так как работа совершается над системой, она отрицательна.
При p, T = const
- d Aобр = dG,
где G – свободная энергия Гиббса,
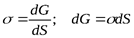 .
.
Таким образом, поверхностное натяжение – это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
Очевидно, что, чем меньше поверхностное натяжение, тем легче образуется новая поверхность. Например, образование пены, сопровождающееся ростом межфазовой поверхности, протекает значительно легче в растворах моющих средств, чем в чистой воде, имеющей большое поверхностное натяжение.
Единица измерения поверхностного натяжения – Дж/м2 = Н/м.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше s.
Поверхностное натяжение позволяет поверхности воды выдерживать вес водяного паука, а пауку шагать по поверхности воды. (Привести пример с иголкой).
Поверхностное натяжение на границе двух конденсированных фаз называет межфазовым. Оно образуется на поверхности раздела двух взаимно нерастворимых жидкостей, твердого тела с жидкостью и двух твердых тел и обозначается соответственно sж-ж, sт-ж, sт-т.
Поверхностное натяжение с ростом температуры снижается. Это связано с ростом давления насыщенного пара и уменьшением нескомпенсированности межмолекулярного взаимодействия. Поэтому при оценке значений s необходимо указывать температуру.
При 293 К поверхностное натяжение воды составляет 72,75 мДж/м2, подсолнечного масла – 33, сырого молока – 45-60, а сухих вин – 46-52 мДж/м2, что ниже s воды.
Согласно принципу минимума свободной энергии, любая фаза будет стремиться уменьшить свою поверхностную энергию. Поэтому текучие системы принимают форму с минимальной поверхностью фазы при заданном объеме – форму сферы.
Влияние кривизны поверхности. Кривизна поверхности Н определяется производной площади поверхности по объему:
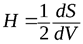 .
.
Кривизна может быть положительной и отрицательной. Если центр окружности находится внутри тела, кривизна поверхности которого определяется, то она положительна; если центр окружности вне этого тела, то кривизна отрицательна. Кривизна плоской поверхности равна нулю, а радиус кривизны – бесконечности. С ростом кривизны поверхности радиус кривизны уменьшается.
Кривизна поверхности оказывает влияние на ряд физико-химических свойств. Так, давление насыщенного пара над вогнутой поверхностью меньше, чем над плоской, т.е. над вогнутой поверхностью пар конденсируется при более низком давлении.
1.2 Классификация дисперсных систем
Нет единого способа классификации дисперсных систем.
Классифицировать дисперсной системы можно на основе следующих общих признаков:
1. по степени дисперсности;
2. по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3. по характеру взаимодействия дисперсной фазы и дисперсионной среды;
4. по структурно-механическим свойствам.
Классификация по степени дисперсности
В зависимости от размеров частиц различают высокодисперсные, среднедисперсные и грубодисперсные системы (табл. 1).
Т а б л и ц а 1
| Класс | Размер частиц, м | Дисперсность | Примеры |
| Высокодисперсные (коллоидные растворы) | 10-9-10-7 | 109-107 | Гидрозоли |
| Среднедисперсные | 10-7-10-5 | 107-105 | Растворимый кофе, сахарная пудра |
| Грубодисперсные | >10-5 | <105 | Крупы |
| Истинные растворы | <10-9 |
Удельная поверхность частиц дисперсной фазы максимальная в высокодиспрсных системах; при переходе к средне- и грубодисперсным системам удельная поверхность уменьшается (рис. 4).
П  ри размере частиц менее 10-9м исчезает поверхность раздела между частицей и средой, образуются молекулярные или ионные растворы (истинные растворы).
ри размере частиц менее 10-9м исчезает поверхность раздела между частицей и средой, образуются молекулярные или ионные растворы (истинные растворы).
Классификация по агрегатному состоянию
Дисперсная фаза и дисперсионная среда могут находиться в любом из трех агрегатных состояний: твердом (Т), жидком (Ж) и газообразном (Г).
Каждая дисперсная система имеет свое обозначение и название: в числителе указывается агрегатное состояние дисперсной фазы, в знаменателе – дисперсионной среды. В общем случае возможно 9 вариантов дисперсных систем (табл. 2).
Т а б л и ц а 2
| Дисперсионная среда | Дисперсная фаза | Дисперсная система | Название системы, примеры |
| Г | Г | Г/Г | Коллоидное состояние невозможно |
| Г | Ж | Ж/Г | Жидкие аэрозоли: туман, дезодорант |
| Г | Т | Т/Г | Твердые аэрозоли, порошки: пыль, дым, сахарная пудра, какао порошок, сухое молоко |
| Ж | Г | Г/Ж | Пены, газовые эмульсии: газированная вода, пиво, пена (пивная, мыльная) |
| Ж | Ж | Ж/Ж | Эмульсии: молоко, майонез |
| Ж | Т | Т/Ж | Золи, суспензии: золи металлов, естественные водоемы, какао тертое, горчица |
| Т | Г | Г/Т | Твердые пены: пемза, пенопласты, сыр, хлеб, пористый шоколад, зефир |
| Т | Ж | Ж/Т | Капиллярные системы: масло, фруктовые начинки |
| Т | Т | Т/Т | Сплавы металлов, драгоценные камни |
В общем случае все высокодисперсные коллоидные системы называют золями. К слову золь добавляют приставку, характеризующую дисперсионную среду. Если дисперсионная среда твердая – ксерозоли, жидкая – лиозоли (гидрозоли), газ – аэрозоли.
Помимо простых дисперсных систем существуют и сложные дисперсные системы, которые состоят из трех и более фаз.
Классификация по характеру взаимодействия
сплошной среды и дисперсной фазы
Все дисперсные системы образуют две большие группы – лиофильные и лиофобные.
Лио – жидкость, филио – любить, фобио – отторгать.
1) лиофильные (гидрофильные) системы характеризуются высокой степенью сродства дисперсной фазы и дисперсионной среды. В таких системах силы межмолекулярного взаимодействия на межфазной границе преобладают над силами межмолекулярного взаимодействия в объеме фазы. Системы образуются самопроизвольно, термодинамически устойчивы.
К лиофильным системам относятся растворы высокомолекулярных соединений (пектина, агароида, крахмала, белков) и коллоидных поверхностно-активных веществ (мыла).
2) лиофобные (гидрофобные) – системы, в которых межмолекулярное взаимодействие частица – среда невелико. Такие системы считают термодинамически неустойчивыми. Для их образования необходимы определенные условия и воздействие извне. Для увеличения устойчивости в них вводят стабилизаторы. Большинство дисперсных систем хлебопекарного, макаронного, кондитерского, сахарного производств относятся к этим системам.
Классификация по структурно-механическим свойствам
Различают системы:
1) свободнодисперсные – системы, в которых дисперсная фаза свободно перемещается по всему объему системы (лиозоли, разбавленные суспензии и эмульсии, аэрозоли, практически все сыпучие порошки и др.)
2) связнодисперсные системы – системы, в которых дисперсная фаза не может свободно передвигаться в сплошной среде. В таких системах возникновение межмолекулярных связей между фазой и средой приводит к образованию структурированных систем (практически все системы пищевых производств). Связнодисперсные системы, в отличие от свободнодисперсных, обладают новыми качествами: прочностью, упругостью, пластичностью.
Связнодисперсные пищевые массы могут быть в виде полупродуктов (тесто, мясной фарш) или готовых продуктов питания (творог, сливочное масло, халва, мармелад, плавленый сыр, дрожжи и т.д.).
В различных отраслях пищевой промышленности широко распространены выпаривание, сепарация, дистилляция, сушка, экстрагирование, кристаллизация и растворение. Все биохимические процессы, лежащие в основе многих пищевых производств, подчиняются законам физической химии. На методах физической химии основано определение кислотности, влажности, содержания сахаров, жиров, белков и витаминов.
Коллоидные растворы — это гетерогенные системы, в которых коллоидные частицы имеют высокую степень раздробленности. Отсюда следует, что их общая поверхность огромна, а поэтому коллоиды обладают высокой адсорбционной (поглотительной) способностью. Коллоиды способны к набуханию, при этом они увеличиваются в объеме, например крахмал. Знание коллоидной химии позволяет создать материалы с заранее заданными свойствами. Сырье, полуфабрикаты и готовая продукция пищевой промышленности представляют собой в основном коллоидные системы. Так, коллоидно-химические процессы лежат в основе производства масла, маргарина, молока, молочных изделий, муки, теста, хлебопекарных изделий, вина, пива и т.п.
Технология приготовления пищи также основывается на коллоидно-химических процессах. Большая часть пищи человека находится в коллоидном состоянии, следовательно, кулинарные процессы имеют коллоидно-химический характер: образование пищевых студней (киселей, желе и проч.); осветление бульонов, основанное на явлении адсорбции и свертывания (коагуляции — характерном свойстве коллоидов); взбивание сливок и белков, связанное с образованием коллоидных систем — пен; получение соусов — эмульсий (коллоидов) и т.п.
Явление диффузии в студнях имеет большое значение для таких производственных процессов, как крашение и дубление (проникновение дубителей в студень коллагена), а также в пищевой промышленности. Так, вводимые в тесто добавки (поваренная соль, сахар, разнообразные улучшители), диффундируя в гелеобразные коллоиды сырья, оказывают влияние на их гидрофильность, набухание и т. д.
Набухание. Процесс набухания очень важен в ряде отраслей пищевой промышленности, перерабатывающей растительное сырье. При тестоведении (хлебопечение, макаронное производство) основную роль играет набухание коллоидов муки. Большую роль набухание играет и при производстве консервов, в состав которых входят крупы и бобовые (фасоль, горох, чечевица и др.)








