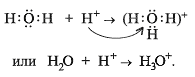Учитель . Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
III Изучение нового материала.
Работа с таблицей «Валентность и электронные конфигурации элементов».
Учитель. Поскольку валентность атома зависит от числа неспаренных электронов, полезно рассмотреть структуры атомов в возбужденных состояниях, учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод ( С) в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:
(Слайд 10)
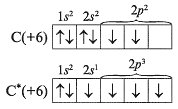
Таким образом, углерод проявляет валентность IV за счет расспаривания 2s2-электронов и перехода одного из них на вакантную орбиталь. (Вакантный – незанятый, пустующий (С.И.Ожегов).)
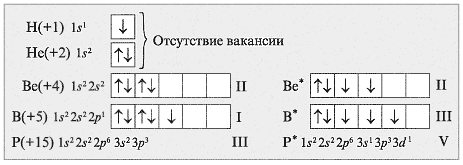
Почему валентность. С – II и IV, а Н – I, Нe – 0, Be – 11, B – III, P – V? Сопоставьте электронографические формулы элементов (схема 1) и установите причину разной валентности.
Работа в группах. ( Слайд11)
Схема 1
Учитель. Итак, от чего зависят валентность и валентные возможности атомов? Давайте рассмотрим эти два понятия во взаимосвязи (схема 2).
(Слайд 12)
Схема 2
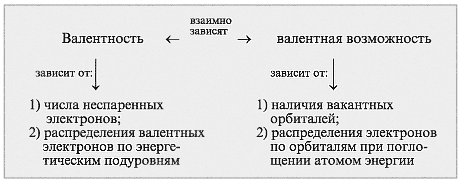
Расход энергии (Е) на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химической связи.
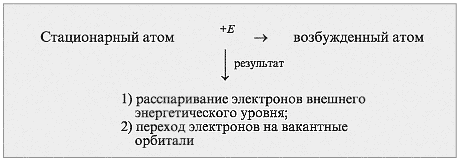
В чем отличие атома в основном (стационарном) состоянии от атома в возбужденном состоянии (схема 3)? (Слайд 13)
Схема 3
Учитель. Могут ли быть следующие валентности у элементов: Li – III, O – IV, Ne – II?
Поясните свой ответ, используя электронные формулы этих элементов (схема 4).
Работа в группах. (Слайд14)
Схема 4
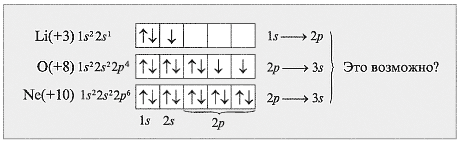
(Ответ. Нет, т. к. в этом случае затраты энергии на перемещение электрона (1s 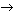 2p или 2p
2p или 2p 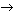 3s) настолько велики, что не могут быть компенсированы энергией, выделяющейся при образовании химической связи.)
3s) настолько велики, что не могут быть компенсированы энергией, выделяющейся при образовании химической связи.)
Учитель. Есть еще один вид валентной возможности атомов – это наличие неподеленных электронных пар (образование ковалентной связи по донорно-акцепторному механизму):
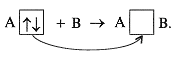
Например: (Слайд 15)
I V Закрепление и общение знаний.
Подводятся итоги, характеризуется работа учащихся на уроке. Затем подводится резюме – отношение ребят к уроку, учебному предмету, учителю.
V Итог урока.
1. Что не понравилось на уроке?
2. Что понравилось?
3. Какие вопросы остались для тебя неясными?
4. Оценка своей работы (обоснованная).
Домашнее задание (по учебнику Г.Е.Рудзитиса и Ф.Г.Фельдмана «Химия-11».
Презентация:
1.Тема.
2.Цели
3.Портреты ученых с хронологическими датами Дж.Дальтон, Ф.А.Кекуле, Э.Франкланд, А.М.Бутлеров, Д.И.Менделеев.
4. Что такое валентность?
Вчитайтесь в определения, взятые из разных источников.
«Валентность химического элемента – способность его атомов соединяться с другими атомами в определенных соотношениях».
«Валентность – способность атомов одного элемента присоединять определенное количество атомов другого элемента».
«Валентность – свойство атомов, вступая в химические соединения, отдавать или принимать определенное количество электронов (электровалентность) или объединять электроны для образования общих для двух атомов электронных пар (ковалентность)».
Какое определение валентности, по вашему мнению, более совершенно и в чем вы видите недостатки других? (Обсуждение в группах.)
5. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод ( С) в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:
Таким образом, углерод проявляет валентность IV за счет расспаривания 2s2-электронов и перехода одного из них на вакантную орбиталь

Таким образом, углерод проявляет валентность IV за счет расспаривания 2s2-электронов и перехода одного из них на вакантную орбиталь
6.Почему валентность. С – II и IV, а Н – I, Нe – 0, Be – 11, B – III, P – V? Сопоставьте электронографические формулы элементов (схема 1) и установите причину разной валентности.
Работа в группах.
Схема 1

7. от чего зависят валентность и валентные возможности атомов? Давайте рассмотрим эти два понятия во взаимосвязи (схема 2).
Схема 2

Расход энергии (Е) на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химической связи.
8. В чем отличие атома в основном (стационарном) состоянии от атома в возбужденном состоянии (схема 3)?
Схема 3

9. Могут ли быть следующие валентности у элементов: Li – III, O – IV, Ne – II?
Поясните свой ответ, используя электронные формулы этих элементов (схема 4).
Работа в группах.
Схема 4

10. еще один вид валентной возможности атомов – это наличие неподеленных электронных пар (образование ковалентной связи по донорно-акцепторному механизму):
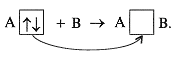
Например: