Определение молекулярной массы воздуха
Муромский институт (филиал)
федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Владимирский государственный университет
имени Александра Григорьевича и
Николая Григорьевича Столетовых»
Кафедра: «ФПМ»
Дисциплина: Физика
Лабораторная работа №6.03
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ВОЗДУХА
Утверждена на методическом
семинаре кафедры ФПМ
Зав. кафедрой ____________
Лабораторная работа № 6.03
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ВОЗДУХА
Цель работы - познакомиться с одним из методов определения молекулярной массы газа и измерить молекулярную массу воздуха.
Приборы и принадлежности: баллон для воздуха, установка для взвешивания или технические весы, манометр, разновесы, вакуумный насос.
ТЕХНИКА БЕЗОПАСНОСТИ
1. Осторожно обращаться со стеклянным баллоном, находящимся в полотняном мешочке.
ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Молекулярной массой называют отношение массы молекулы данного вещества к 1/12 массы атома углерода С 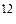 .
.
Молекулярная масса согласно определению может быть представлена, как сумма атомных масс элементов, составляющих молекулу
m = 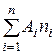 (1)
(1)
где А 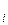 - атомная масса i-го элемента, входящего а состав молекулы ;
- атомная масса i-го элемента, входящего а состав молекулы ;
n 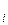 - число атомов.
- число атомов.
Методы определения молекулярной массы разделяются на две групп-пы – абсолютные и статистические. К абсолютным методам, дающим "истинное" значение молекулярной массы относится метод масспектроскопии. Другие методы дают лишь среднестатистическое значение молекулярной массы.
Определение молекулярной массы газов основано на уравнении состояния газа
PV = 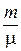 RT (2)
RT (2)
где Р – давление газа,
m, V – его масса и объем,
Т – абсолютная температура
R – универсальная газовая постоянная,
m – среднестатистическая молекулярная масса.
Уравнение 2 справедливо лишь для идеального газа. Идеальный газ – это такой газ, между молекулами которого отсутствуют силы взаимодействия (притяжения и отталкивания). Молекулы идеального газа представляются в виде упругих шариков бесконечно малого размера. У реальных газов существуют силы взаимодействия между молекулами, и не всегда молекулы можно рассматривать как упругие шарики исчезающе малых размеров, поэтому реальные газы отступают от закона (2).
Однако при не слишком больших давлениях, когда молекулы газа могут свободно пробегать до столкновения большие расстояния, взаимодействием молекул можно пренебречь, можно пренебречь также и размерами молекул (когда объем газа достаточно велик), тогда реальный газ будет близок к идеальному и уравнение (2) может быть применено. При атмосферном давлении и комнатных температур многие газы (азот, водород, гелий, кислород, воздух и т.д.) можно с достаточно хорошим приближением считать идеальным газом.
Важной характеристикой движения молекул является средняя длина свободного пробега. Молекулы в газе находятся в состоянии непрерывного и хаотического движения, сталкиваются друг с другом и между столкновениями проходят свободно некоторый путь l. Длина этого пути между двумя столкновениями различна, но, благодаря большому числу молекул и беспорядочности их движения можно говорить о средней длине свободного пробега молекул. Среднюю длину свободного пробега молекул можно определить по формуле
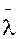 =
= 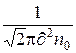 ,
,
где ¶ – эффективный диаметр молекулы (для воздуха ¶ = 0.27·10 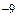 м),
м),
n 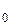 – число молекул в единице объема.
– число молекул в единице объема.
Так как
n 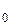 =
= 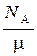
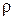 ,
,
то с учетом этого формула, для l имеет вид:
l = 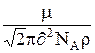 ,
,
где 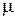 – молекулярная масса газа, N
– молекулярная масса газа, N 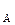 – число Авогадро, r – плотность газа.
– число Авогадро, r – плотность газа.
Пусть воздух в открытом баллоне занимает объем V, масса его т 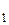 , давление атмосферное P
, давление атмосферное P 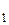 ; откачиваем воздух из баллона до P
; откачиваем воздух из баллона до P 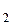 . Теперь масса воздуха в баллоне будет m
. Теперь масса воздуха в баллоне будет m 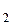 . Для этих двух состояний запишем уравнение (2)
. Для этих двух состояний запишем уравнение (2)
P 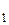 V =
V = 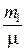 RT (3)
RT (3)
P 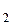 V =
V = 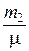 RT (4)
RT (4)
Вычитая из (3) (4), выразим m.
m = 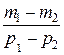
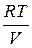 =
= 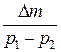
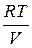 (5)
(5)
Таким образом, зная изменение массы при изменениях давления, можно найти молекулярную массу воздуха по формуле (5).
ОПИСАНИЕ УСТАНОВКИ
Общий вид установки показан на рис. 1. Установка состоит из вакуумного насоса (1), крана(2) (с помощью крана 2 система отсоединяется от вакуумного насоса), вакуумметра (3). Поворот стрелки-указателя вакуумметра пропорционален достигнутому в системе разрежению, т.е. разности между атмосферные давлением и давлением воздуха в установке. Нулевое значение на шкале вакуумметра соответствует атмосферному давлении в установке. Прибор начинает показывать только при откачке воздуха из системы, т.е. при давлении воздуха в установке ниже атмосферного.
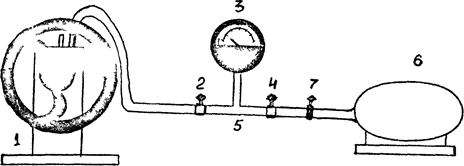
Рис. 1
С помощью крана 4 система соединяется с атмосферой. На рис. 1 изображен вакуумпровод (5), съемный баллон (6) (объемом I/1225 мл) с резиновой трубкой и зажимом (7), служащим для отсоединения баллона 6 от атмосферы при взвешивании баллона.
ВЫПОЛНЕНИЕ РАБОТЫ
Задание 1. Определение молекулярной массы воздуха.
1. Открываем краны 2 и 4, зажим 7 и отсоединяем баллон 6 от установки. Взвешиваем баллон 6 вместе с резиновой трубкой и зажимом 7 и записываем результаты измерений в таблицу I. Взвешивание необходимо проводить с достаточно высокой степенью точности и на эту операцию обратить особое внимание.
2. Присоединяем баллон 6 к установке и откачиваем воздух из баллона так, чтобы изменение давления составило 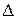 P = 0,1
P = 0,1 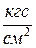 . Закрываем кран 2 и заносим
. Закрываем кран 2 и заносим 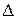 P в таблицу измерений. Закрываем кран 4, за жим 7 и отсоединяем баллон 6 от установки и взвешиваем его. Результаты измерений заносим в таблицу.
P в таблицу измерений. Закрываем кран 4, за жим 7 и отсоединяем баллон 6 от установки и взвешиваем его. Результаты измерений заносим в таблицу.
3. Открываем зажим 7, плавно открываем краны 2 и 4 и пункт 2 повторяем еще 4 раза для других значений 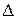 P.
P.
4. По результатам измерений вычисляем m воздуха и оцениваем погрешность измерений.
Задание 2. Определение плотности воздуха.
Плотность воздуха определим, используя уравнение Менделеева – Клайперона для идеальных газов.
PV = 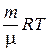 .
.
Из этого уравнения следует, что, так как 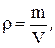 то
то
r = 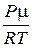 ,
,
где R = 8,31*10 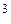 Дж/(кмоль·К), универсальная газовая постоянная.
Дж/(кмоль·К), универсальная газовая постоянная.
Определим сначала плотность воздуха в баллоне до откачки, приняв, что давление P=P 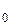 равно атмосферному давлению (P
равно атмосферному давлению (P 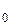 = 101 кПа). Затем определим плотности воздуха при различных
= 101 кПа). Затем определим плотности воздуха при различных 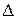 P, взятых из таблицы измерений, считая, что давление в колбе равно P = P
P, взятых из таблицы измерений, считая, что давление в колбе равно P = P 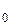 -
- 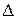 P.
P.
По результатам расчета построить график зависимости плотности от давления P: 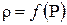
ТАБЛИЦА ИЗМЕРЕНИЙ
m 
| m 
| 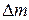
| 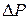
| m | m 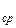
| 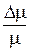
| 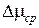
| 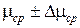
| r | ||
| 1 | 0,2 | ||||||||||
| 2 | 0,4 | ||||||||||
| 3 | 0,6 | ||||||||||
| 4 | 0,8 | ||||||||||
| 5 | 1 |
Задание 3. По вычисленным расчетам r определить длину волны свободного пробега l и построить график зависимости l от r: 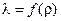 .
.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Перечислите основные положения молекулярно-кинетической теории идеальных газов.
2. Какие физические величины называют параметрами состояния газа, дайте их определение.
3. Сформулируйте законы идеальных газов.
4. При каких условиях газ подчиняется законам идеального газа?
5. При каких условиях уравнение Клапейрона-Менделеева применимо к газам.
6. Что такое молекулярная масса, от чего зависит молекулярная масса.
7. Плотность воздуха, от чего она зависит?
8. Длина свободного пробега молекул газа и эффективный диаметр.
9. Выведите формулы для расчета m и r.
10. Какие измерения надо провести, чтобы рассчитать молекулярную массу m и плотность воздуха r.
Список использованной литературы
1. Савельев И.В. Курс общей физики. М.: Наука, 1970. Т.1, § 98.
2. А.А. Детлаф, Б.М. Яворский. Курс физики. М.: Изд-во "Высшая школа", 1973, стр. 175-179.








